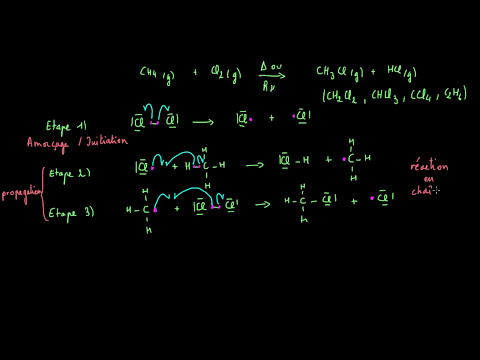Introduction à la substitution nucléophile aromatique
La substitution nucléophile aromatique est une classe de réactions fondamentales en chimie organique, impliquant des composés aromatiques et des nucléophiles, où des groupes fonctionnels sont remplacés.
1.1 Définition et importance en chimie organique
La substitution nucléophile aromatique est une réaction chimique qui consiste en la substitution d’un groupe fonctionnel par un nucléophile sur un cycle aromatique. Cette réaction est fondamentale en chimie organique car elle permet de modifier les propriétés chimiques et physiques des composés aromatiques.
Cette classe de réactions est très importante car elle permet la synthèse de nombreux composés naturels et artificiels utilisés dans divers domaines tels que la pharmacie, l’agrochimie et les matériaux.
Les réactions de substitution nucléophile aromatique impliquent souvent des mécanismes complexes qui dépendent de la nature des composés aromatiques et des nucléophiles impliqués.
Cette complexité rend cette classe de réactions très intéressante pour les chimistes organiciens qui cherchent à comprendre et à maîtriser ces processus pour concevoir de nouvelles molécules aux propriétés spécifiques.
1.2 Contexte et objectifs de l’article
Dans ce contexte, il est essentiel de comprendre les mécanismes et les facteurs qui influencent la substitution nucléophile aromatique pour concevoir de nouvelles molécules aux propriétés spécifiques.
L’objectif de cet article est de présenter les principes fondamentaux de la substitution nucléophile aromatique, en mettant en évidence les mécanismes et les facteurs clés qui régissent cette classe de réactions.
Cet article vise également à illustrer l’importance de la substitution nucléophile aromatique dans la synthèse de composés organiques, en présentant des exemples concrets de réactions et leurs applications.
Enfin, nous aborderons les effets des substituants sur la réactivité aromatique et leurs implications pour la conception de molécules aux propriétés spécifiques.
Mécanismes de substitution nucléophile aromatique
Les mécanismes de substitution nucléophile aromatique impliquent des étapes clés, notamment la formation d’un intermédiaire de Meisenheimer et la restitution de l’aromaticité.
2.1 Le mécanisme SNAr ⁚ principes et étapes
Le mécanisme SNAr (Substitution Nucléophile Aromatique) est un processus en deux étapes, impliquant la formation d’un intermédiaire de Meisenheimer et la restitution de l’aromaticité. Dans la première étape, le nucléophile attaque l’atome de carbone porteur du groupe leaving, formant un intermédiaire de Meisenheimer. Ce dernier est un espèce instable, caractérisée par une charge négative localisée sur l’atome de carbone.
Dans la deuxième étape, le groupe leaving part, restaurant l’aromaticité du système. Les étapes du mécanisme SNAr sont influencées par les effets électroniques et stériques des substituants, ainsi que par la nature du nucléophile et du groupe leaving.
2.2 Exemples de réactions SNAr et leur importance
Les réactions SNAr sont très courantes en chimie organique et trouvent des applications dans la synthèse de nombreux composés aromatiques. Par exemple, la réaction de substitution nucléophile aromatique entre le 2,4-dinitrochlorobenzène et l’hydroxyde de sodium permet d’obtenir le 2,4-dinitrophénol, un composé utilisé comme herbicide.
D’autres exemples incluent la synthèse de médicaments, tels que les antibiotiques et les analgésiques, qui impliquent souvent des réactions SNAr. De plus, les réactions SNAr sont également utilisées dans l’industrie des plastiques et des colorants, pour produire des composés aromatiques spécifiques.
Effets des substituants sur la réactivité aromatique
Les substituants sur les anneaux aromatiques influencent considérablement la réactivité chimique, modifiant les propriétés électroniques et stériques des molécules.
3.1 Effets électroniques et stériques des substituants
Les substituants exercent des effets électroniques et stériques sur les anneaux aromatiques, influençant ainsi la réactivité chimique. Les substituants électron-donneurs, tels que les groupes alkyle ou amine, augmentent la densité électronique du cycle aromatique, rendant les réactions de substitution nucléophile plus faciles.
D’un autre côté, les substituants électron-attrapeurs, tels que les groupes nitro ou halogène, réduisent la densité électronique, rendant les réactions plus difficiles. Les effets stériques, quant à eux, dépendent de la taille et de la forme des substituants, pouvant bloquer ou faciliter l’accès des nucléophiles aux sites de substitution.
3.2 Exemples d’effets de substituants sur la réactivité aromatique
Les exemples de l’effet des substituants sur la réactivité aromatique sont nombreux. Par exemple, le groupe méthyle (-CH₃) est un substituant électron-donneur qui facilite la substitution nucléophile aromatique.
Inversement, le groupe nitro (-NO₂) est un substituant électron-attrapeur qui la rend plus difficile. Les halogènes, tels que le chlore (-Cl) ou le bromure (-Br), ont un effet ambigu, dépendant de leur position sur l’anneau aromatique.
De plus, les effets stériques sont bien illustrés par l’exemple du groupe tert-butyle (-C(CH₃)₃), qui bloque l’accès des nucléophiles au site de substitution en raison de sa grande taille.
Exemples de substitution nucléophile aromatique
Cette section présente des exemples concrets de réactions de substitution nucléophile aromatique, mettant en évidence la diversité des nucléophiles et des composés aromatiques impliqués.
4.1 Exemples de réactions SNAr avec des nucléophiles courants
Les nucléophiles courants tels que les ions hydroxyde (OH–), les ions alkoxide (RO–) et les amines (NR2) réagissent avec les composés aromatiques pour former des produits de substitution.
Par exemple, la réaction entre le 2-chloronitrobenzène et l’ion hydroxyde conduit à la formation du 2-nitrophénol ⁚
- 2-ClC6H4NO2 + OH– → 2-HOC6H4NO2 + Cl–
Ces réactions SNAr impliquant des nucléophiles courants sont couramment utilisées en synthèse organique pour introduire des groupes fonctionnels spécifiques sur des composés aromatiques.
4.2 Exemples de réactions SNAr avec des nucléophiles spécifiques
Certains nucléophiles spécifiques, tels que les thiolates (RS–), les sélénolates (RSe–) et les phosphines (PR3), peuvent également réagir avec les composés aromatiques pour former des produits de substitution.
Par exemple, la réaction entre le 2-chloronitrobenzène et le thiolate d’éthyle conduit à la formation du 2-nitrothiophénol ⁚
Ces réactions SNAr impliquant des nucléophiles spécifiques offrent une grande flexibilité pour introduire des groupes fonctionnels variés sur des composés aromatiques.
Conclusion et perspectives
En conclusion, la substitution nucléophile aromatique est une classe de réactions essentielles en chimie organique, qui permet d’introduire des groupes fonctionnels variés sur des composés aromatiques.
Les mécanismes SNAr, les effets des substituants et les exemples de réactions présentés dans cet article montrent la complexité et la richesse de cette classe de réactions.
Les progrès futurs dans la compréhension des mécanismes de réaction et des effets des substituants devraient ouvrir de nouvelles voies pour la synthèse de composés aromatiques fonctionnalisés, avec des applications potentielles dans les domaines de la pharmacie, de la matière plastique et des matériaux.
Cette thématique continue de susciter un intérêt croissant dans la communauté scientifique, et de nouvelles découvertes sont attendues dans les années à venir.