Introduction
Une solution diluée est un mélange homogène de deux ou plusieurs substances, où l’une des substances, le soluté, est dissoute dans une autre, le solvant, à une concentration faible.
Définition d’une solution diluée
Une solution diluée est un mélange homogène de deux ou plusieurs substances, où l’une des substances, appelée soluté, est dissoute dans une autre, appelée solvant, à une concentration faible. Le soluté est la substance qui est dissoute, tandis que le solvant est la substance qui fait office de support pour le soluté. Les solutions diluées sont caractérisées par une concentration de soluté inférieure à 1%. Elles peuvent être obtenues en ajoutant une petite quantité de soluté à une grande quantité de solvant. Les solutions diluées sont couramment utilisées en chimie, en biologie et en médecine pour étudier les propriétés des substances et leurs interactions. Elles permettent également de contrôler les concentrations des substances impliquées dans les réactions chimiques.
Importance des solutions diluées dans la chimie
Les solutions diluées jouent un rôle crucial dans la chimie, car elles permettent d’étudier les propriétés des substances et leurs interactions. En effet, les solutions diluées offrent la possibilité de contrôler la concentration des substances impliquées dans les réactions chimiques, ce qui est essentiel pour comprendre les mécanismes réactionnels et optimiser les conditions de réaction. De plus, les solutions diluées sont souvent utilisées comme buffer pour maintenir un pH constant, ce qui est particulièrement important dans les réactions enzymatiques et les études de biochimie. En outre, les solutions diluées sont également utilisées pour préparer des échantillons pour l’analyse spectroscopique et chromatographique. En fin de compte, les solutions diluées sont essentielles pour la compréhension et l’application des principes chimiques dans de nombreux domaines.
Caractéristiques d’une solution diluée
Les caractéristiques d’une solution diluée incluent sa concentration, exprimée en termes de molarité, de molalité, de fraction molaire et de fraction volumique, qui définissent la quantité de soluté dissous.
Concentration
La concentration d’une solution diluée est une mesure de la quantité de soluté présente dans un volume donné de solvant. Elle peut être exprimée de différentes manières, mais les plus courantes sont la molarité, la molalité, la fraction molaire et la fraction volumique. La molarité (M) est définie comme le nombre de moles de soluté par litre de solution. La molalité (m) est quant à elle le nombre de moles de soluté par kilogramme de solvant. La fraction molaire (x) est la proportion de moles de soluté par rapport au nombre total de moles de soluté et de solvant. Enfin, la fraction volumique (φ) est la proportion de volume de soluté par rapport au volume total de la solution.
Ces différentes unités de concentration sont utilisées en fonction de la nature du soluté et du solvant, ainsi que des besoins spécifiques de l’expérience ou de l’application considérée.
Molalité, fraction molaire et fraction volumique
La molalité (m) est une mesure de la concentration d’une solution diluée qui prend en compte la masse du solvant. Elle est exprimée en moles de soluté par kilogramme de solvant (mol/kg). La fraction molaire (x) est une autre manière d’exprimer la concentration d’une solution diluée, qui représente la proportion de moles de soluté par rapport au nombre total de moles de soluté et de solvant.
La fraction volumique (φ) est une mesure de la concentration qui prend en compte les volumes du soluté et du solvant. Elle est exprimée en pourcentage du volume de soluté par rapport au volume total de la solution. Ces trois unités de concentration sont liées entre elles par des relations mathématiques précises, ce qui permet de passer facilement d’une unité à une autre.
Ces différents modes d’expression de la concentration sont utiles pour décrire les propriétés physico-chimiques des solutions diluées et pour effectuer des calculs précis dans les domaines de la chimie et de la physique.
Facteurs influençant la concentration d’une solution diluée
Les facteurs qui influencent la concentration d’une solution diluée incluent la nature du soluté et du solvant, la température, la pression et les réactions chimiques qui ont lieu dans la solution.
Le soluté et le solvant
Le soluté et le solvant sont les deux composants essentiels d’une solution diluée. Le soluté est la substance qui est dissoute dans le solvant, tandis que le solvant est la substance qui fait office de milieu de dissolution. La nature chimique du soluté et du solvant joue un rôle crucial dans la formation d’une solution diluée. Les propriétés physico-chimiques du soluté, telles que sa solubilité, sa polarité et sa taille moléculaire, influencent sa capacité à se dissoudre dans le solvant. De même, les propriétés du solvant, telles que sa polarité, sa viscosité et sa pression de vapeur, affectent sa capacité à dissoudre le soluté. L’interaction entre le soluté et le solvant est donc essentielle pour comprendre les propriétés d’une solution diluée.
Le mélange et la réaction chimique
Le mélange et la réaction chimique sont deux phénomènes liés à la formation d’une solution diluée. Lorsqu’un soluté est ajouté à un solvant, il se produit un mélange homogène des deux substances. Cependant, il est possible que se produise une réaction chimique entre le soluté et le solvant, entraînant la formation de nouveaux produits. Dans ce cas, la solution diluée n’est plus un simple mélange de deux substances, mais un système chimique complexe. Les réactions chimiques peuvent influencer la concentration du soluté, la stabilité de la solution et même la formation de précipités. Il est donc essentiel de prendre en compte la possibilité de réactions chimiques lors de la préparation d’une solution diluée.
La réaction acide-base et le pH
Les réactions acide-base jouent un rôle crucial dans les solutions diluées, notamment en ce qui concerne la régulation du pH. Lorsqu’un acide ou une base forte est ajouté à une solution, il se produit une réaction d’équilibre qui influence le pH de la solution. Le pH, qui représente la concentration en ions hydrogène, est un paramètre crucial pour déterminer la stabilité et la réactivité d’une solution diluée. Les solutions diluées peuvent être tamponnées par des buffers, des systèmes capables de maintenir un pH constant malgré l’ajout d’acides ou de bases. Les réactions acide-base et la régulation du pH sont donc essentielles pour comprendre le comportement des solutions diluées et leur utilisation dans différents domaines tels que la chimie, la biologie et la pharmacologie.
Exemples de solutions diluées
Les solutions diluées sont couramment rencontrées dans divers domaines, allant des solutions aqueuses comme l’eau de mer ou les liquides biologiques aux solutions organiques utilisées dans l’industrie chimique et pharmaceutique.
Les solutions aqueuses
Les solutions aqueuses sont des solutions diluées où le solvant est l’eau. Ces solutions sont très courantes dans la nature et jouent un rôle crucial dans de nombreux processus biologiques et chimiques.
Les exemples de solutions aqueuses incluent l’eau de mer, qui est une solution diluée de sels minéraux tels que le sodium chloride et le magnésium, ainsi que les liquides biologiques tels que le sang et les fluides corporels.
Ces solutions aqueuses ont des propriétés chimiques et physiques particulières, telles que la conductivité électrique et la pression osmotique, qui dépendent de la concentration du soluté.
Les solutions aqueuses sont également utilisées dans diverses applications, notamment en chimie analytique, en biologie moléculaire et en médecine.
Les solutions organiques
Les solutions organiques sont des solutions diluées où le solvant est un composé organique, tel qu’un hydrocarbure, un alcool ou un éther.
Ces solutions sont couramment utilisées en chimie organique pour préparer et isoler des composés organiques, ainsi que dans l’industrie pharmaceutique pour produire des médicaments.
Les exemples de solutions organiques incluent des solutions de alcanes, tels que le pentane ou l’hexane, des solutions d’alcools, tels que l’éthanol ou le propanol, et des solutions d’éthers, tels que l’éther diéthylique.
Ces solutions organiques ont des propriétés physico-chimiques spécifiques, telles que la polarité et la volatilité, qui dépendent de la nature du solvant et du soluté.
Elles sont également utilisées comme solvants pour nettoyer et dégraisser les surfaces, ainsi que comme ingrédients dans les peintures et les vernis.
En résumé, les solutions diluées sont des mélanges homogènes de deux ou plusieurs substances, où l’une des substances, le soluté, est dissoute dans une autre, le solvant, à une concentration faible.
Les caractéristiques des solutions diluées, telles que la concentration, la molalité, la fraction molaire et la fraction volumique, sont essentielles pour comprendre leur comportement et leurs applications.
Les facteurs influençant la concentration d’une solution diluée, tels que le soluté et le solvant, le mélange et la réaction chimique, ainsi que la réaction acide-base et le pH, doivent être pris en compte lors de la préparation et de l’utilisation de ces solutions.
Les exemples de solutions diluées, qu’elles soient aqueuses ou organiques, illustrent leur importance dans de nombreux domaines, tels que la chimie, la biologie, la pharmacie et l’industrie.
En fin de compte, la compréhension des solutions diluées est essentielle pour de nombreuses applications scientifiques et industrielles.
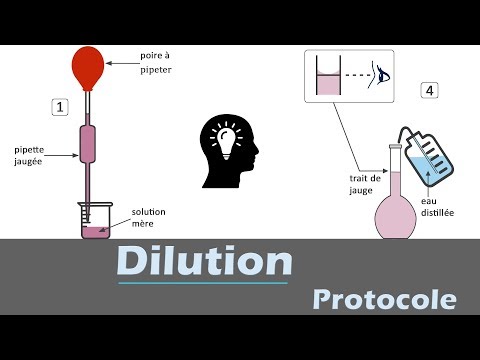
Je suggère toutefois que l\
Cet article offre une excellente introduction aux applications pratiques des solutions diluées en chimie.
Je suis impressionné par la précision avec laquelle l\
J\
L\
La structure logique de l\
Je tiens à féliciter l\
Je recommande cet article à tous ceux qui cherchent à approfondir leurs connaissances sur les solutions diluées.
Cependant, je pense que certains termes techniques auraient pu être définis plus clairement pour faciliter la lecture.