I. Introduction
L’oxyde de soufre est un composé chimique volatile, produit par la combustion de combustibles fossiles, qui contribue à la pollution atmosphérique et aux problèmes respiratoires.
A. Définition de l’oxyde de soufre
L’oxyde de soufre est un composé chimique inorganique, de formule SOx, où x peut varier de 1 à 3. Les deux formes les plus courantes sont le dioxyde de soufre (SO2) et le trioxyde de soufre (SO3). L’oxyde de soufre est un gaz incolore, toxique et corrosif, qui se forme lors de la combustion de combustibles fossiles riches en soufre, tels que le charbon et le pétrole.
Ce composé est également connu sous le nom de sulfure d’oxygne ou anhydride sulfurique. Il est très soluble dans l’eau, formant des acides forts tels que l’acide sulfurique.
II. Propriétés de l’oxyde de soufre
L’oxyde de soufre présente des propriétés physiques et chimiques spécifiques, influençant ses réactions et ses effets sur l’environnement et la santé humaine.
A. Caractéristiques physiques
L’oxyde de soufre est un gaz incolore, toxique et corrosif, avec une odeur piquante et désagréable. Il se présente sous forme de vapeur à température ambiante et a une densité légèrement supérieure à celle de l’air.
Ses caractéristiques physiques incluent une masse molaire de 64,06 g/mol, un point d’ébullition de -10°C et un point de fusion de -72°C. L’oxyde de soufre est également soluble dans l’eau, ce qui facilite sa dispersion dans l’environnement;
Ces propriétés physiques influent sur la façon dont l’oxyde de soufre interagit avec son environnement et affecte les êtres vivants, en particulier lorsqu’il est libéré dans l’atmosphère.
B. Caractéristiques chimiques
L’oxyde de soufre est un composé chimique qui appartient à la famille des oxydes. Sa formule chimique est SO2, indiquant qu’il est composé d’un atome de soufre et de deux atomes d’oxygène.
Chimiquement, l’oxyde de soufre est un agent oxydant puissant, capable de réagir avec de nombreux éléments pour former des composés stables. Il est également un acide de Lewis, ce qui signifie qu’il peut accepter des électrons pour former des liaisons covalentes.
Ces propriétés chimiques confèrent à l’oxyde de soufre une grande réactivité, qui explique pourquoi il est impliqué dans de nombreux processus environnementaux et biologiques, tels que la formation d’acide sulfurique et la production de pluvio-acides.
III. Dangers de l’oxyde de soufre
L’oxyde de soufre est un polluant dangereux pour l’environnement et la santé humaine, entraînant des problèmes respiratoires, de l’acidification des pluies et des dommages écologiques.
A. Impact sur l’environnement
L’oxyde de soufre est un polluant atmosphérique qui contribue à la formation d’acide sulfurique et d’acide nitrique, responsables de l’acidification des pluies et des sols. Cela affecte négativement les écosystèmes, en particulier les forêts et les cours d’eau, en altérant leur pH et en modifiant la biodiversité.
De plus, l’oxyde de soufre est un gaz à effet de serre qui participe au réchauffement climatique. Il contribue également à la formation de smog et de particules fines, qui peuvent être transportées sur de longues distances, affectant ainsi la qualité de l’air à grande échelle.
Il est donc essentiel de réduire les émissions d’oxyde de soufre pour protéger l’environnement et préserver la santé publique.
B. Effets sur la santé
L’inhalation d’oxyde de soufre peut entraîner des problèmes respiratoires graves, notamment l’asthme, la bronchite et la pneumonie. Les personnes sensibles, telles que les enfants, les personnes âgées et celles souffrant de maladies respiratoires, sont particulièrement vulnérables.
L’exposition à l’oxyde de soufre peut également causer des irritations oculaires, cutanées et des voies respiratoires. À long terme, elle peut contribuer à l’apparition de cancers et de maladies cardiovasculaires.
Il est donc essentiel de prendre des mesures de protection adéquates pour réduire l’exposition à l’oxyde de soufre, en particulier dans les zones où les concentrations sont élevées, comme près des sources d’émission industrielles ou des zones de trafic dense.
C. Acid rain et pollution de l’air
L’oxyde de soufre est un précurseur majeur de la pluie acide, qui résulte de la combinaison de l’oxyde de soufre avec l’eau et l’oxygène dans l’atmosphère.
La pluie acide peut avoir des effets dévastateurs sur les écosystèmes, en altérant le pH des sols et des eaux, et en tuant les plantes et les animaux sensibles.
De plus, l’oxyde de soufre contribue à la pollution de l’air, en formant des particules fines qui peuvent pénétrer profondément dans les poumons et causer des problèmes respiratoires.
Il est donc essentiel de réduire les émissions d’oxyde de soufre pour protéger l’environnement et la santé humaine.
IV. Utilisations de l’oxyde de soufre
L’oxyde de soufre est utilisé dans divers domaines, notamment les applications industrielles, les conservateurs alimentaires et la vinification, où il joue un rôle essentiel dans la production de vins.
A. Applications industrielles
Dans le domaine industriel, l’oxyde de soufre est utilisé comme matière première pour la production de produits chimiques tels que l’acide sulfurique, l’acide sulfureux et les sulfates. Il est également employé comme agent de blanchiment et de désinfection dans l’industrie papetière et textile. De plus, l’oxyde de soufre est utilisé comme réactif dans la production de produits pharmaceutiques, de pesticides et de fertilisants. Dans l’industrie du caoutchouc, il est employé comme vulcanisateur pour améliorer la résistance et la durée de vie des produits en caoutchouc. Enfin, l’oxyde de soufre est également utilisé dans la production de peintures et de vernis, où il contribue à améliorer leur résistance aux intempéries.
B. Utilisations dans l’alimentation
Dans le domaine alimentaire, l’oxyde de soufre est utilisé comme additif alimentaire, notamment comme conservateur et antioxydant. Il est ajouté à certains aliments pour prévenir l’oxydation et la dégradation, ce qui permet de prolonger leur durée de conservation. Les fruits secs, les fruits confits et les légumes sont souvent traités avec de l’oxyde de soufre pour les conserver. De plus, l’oxyde de soufre est également utilisé comme exhausteur de saveur dans certaines boissons, telles que les jus de fruits et les vins. Cependant, son utilisation est strictement réglementée en raison de ses effets potentiellement nocifs sur la santé humaine.
C. Rôle dans la vinification
Dans la vinification, l’oxyde de soufre joue un rôle crucial en tant qu’agent antioxydant et antibactérien. Il est ajouté au moût ou au vin pour prévenir l’oxydation et la contamination bactérienne, ce qui permet de protéger la qualité du vin et de prévenir la formation de défauts organoleptiques. L’oxyde de soufre empêche également la croissance de levures et de bactéries indésirables, ce qui permet de contrôler la fermentation et d’obtenir un vin de qualité supérieure. Cependant, il est important de gérer soigneusement les niveaux d’oxyde de soufre dans le vin, car des concentrations excessives peuvent affecter négativement son goût et son arôme.
V. Sources d’émission de l’oxyde de soufre
Les sources d’émission de l’oxyde de soufre comprennent la combustion de combustibles fossiles, les activités industrielles et les processus naturels tels que les éruptions volcaniques.
A. Combustion des combustibles fossiles
La combustion des combustibles fossiles, tels que le charbon, le pétrole et le gaz naturel, est la principale source d’émission d’oxyde de soufre dans l’atmosphère. Lorsque ces combustibles sont brûlés, le soufre qu’ils contiennent se combine avec l’oxygène pour former du dioxyde de soufre (SO2). Ce gaz est ensuite libéré dans l’atmosphère, où il peut réagir avec d’autres polluants pour former des particules fines et des aérosols, qui contribuent à la pollution de l’air et aux problèmes de santé respiratoire.
B. Réactions de combustion
Les réactions de combustion impliquant le soufre sont complexes et dépendent de nombreux facteurs, tels que la température, la pression et la présence d’autres éléments. Cependant, la réaction globale peut être représentée par la combustion du soufre élémentaire ⁚ S + O2 → SO2. Cette réaction libère de l’énergie sous forme de chaleur et produit du dioxyde de soufre٫ qui est un gaz toxique et corrosif. Dans les centrales électriques et les industries٫ les réactions de combustion sont souvent optimisées pour minimiser les émissions d’oxyde de soufre٫ mais celles-ci restent une préoccupation majeure pour l’environnement et la santé publique.
VI. Conclusion
En fin de compte, l’oxyde de soufre est un composé chimique complexe qui joue un rôle central dans de nombreux domaines, allant de la production d’énergie à la vinification. Cependant, ses effets négatifs sur l’environnement et la santé publique ne doivent pas être négligés. Il est essentiel de mettre en place des mesures pour réduire les émissions d’oxyde de soufre et promouvoir des pratiques plus durables. En comprenant mieux les propriétés et les dangers de l’oxyde de soufre, nous pouvons travailler ensemble pour minimiser son impact négatif et protéger notre environnement pour les générations à venir.
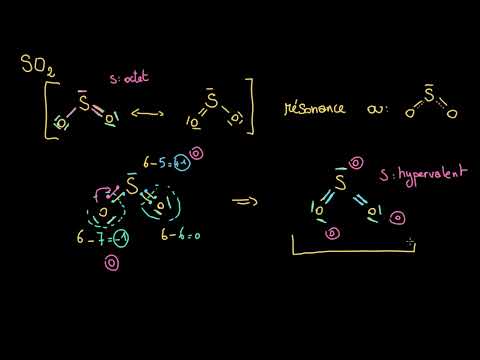
Je suis impressionné par la précision des informations fournies sur les propriétés physiques et chimiques du dioxyde et trioxyde de suvre ; cela montre une grande maîtrise du sujet.
Je tiens à féliciter les auteurs pour cette introduction pertinente sur l
Je recommande cet article à tous ceux qui cherchent à comprendre les mécanismes derrière la pollution atmosphérique causée par l
La définition donnée ici permet une bonne compréhension du sujet abordé ; cependant, il aurait été utile d
Il aurait été intéressant d
Je suggère que les auteurs ajoutent des références bibliographiques pour étayer leurs affirmations scientifiques ; cela renforcerait encore plus la crédibilité du texte.
La structure logique adoptée pour présenter les informations sur les propriétés physiques et chimiques facilite considérablement la lecture ; bravo !