Introduction
Les non-électrolytes sont des substances chimiques qui ne se dissociant pas en ions lorsqu’elles sont dissoutes dans un solvant, contrairement aux électrolytes qui conduisent l’électricité.
Définition des non-électrolytes
Les non-électrolytes sont des substances chimiques qui ne se dissociant pas en ions lorsqu’elles sont dissoutes dans un solvant. Cette propriété leur permet de ne pas conduire l’électricité, contrairement aux électrolytes. Cette définition implique que les non-électrolytes ne possèdent pas de charges électriques, ce qui signifie qu’ils ne peuvent pas participer à des réactions chimiques impliquant des transferts d’électrons. Les non-électrolytes sont souvent des molécules covalentes, où les atomes sont liés par des liaisons chimiques fortes. Cela leur confère une grande stabilité et une faible réactivité. Les non-électrolytes jouent un rôle important dans de nombreux processus chimiques et biologiques, notamment dans la formation de solutions, la catalyse et la régulation des réactions chimiques.
Importance des non-électrolytes en chimie
Les non-électrolytes jouent un rôle crucial dans de nombreux domaines de la chimie, notamment en chimie organique, inorganique et biochimique. Ils permettent la formation de solutions stables, essentielles pour de nombreuses applications industrielles et biotechnologiques. Les non-électrolytes servent également de solvants pour les réactions chimiques, facilitant la mise en contact des réactifs et améliorant les rendements. De plus, ils peuvent agir comme des catalyseurs, accélérant les réactions chimiques sans être consommés. En biochimie, les non-électrolytes sont impliqués dans de nombreux processus métaboliques, tels que la glycolyse et la fermentation. Enfin, les non-électrolytes sont utilisés comme matériaux de référence pour les études de propriétés chimiques et physiques.
Propriétés chimiques des non-électrolytes
Les non-électrolytes présentent des propriétés chimiques spécifiques, telles que la structure moléculaire, les propriétés physiques et les forces intermoléculaires, qui influencent leur comportement chimique et physique.
Structure moléculaire
La structure moléculaire des non-électrolytes est caractérisée par l’arrangement des atomes dans la molécule. Les non-électrolytes peuvent avoir des structures moléculaires variées, allant des molécules simples aux molécules complexes.
Certaines molécules non-électrolytes, comme les hydrocarbures, ont des structures linéaires ou ramifiées, tandis que d’autres, comme les composés cycliques, ont des structures en anneaux.
La structure moléculaire des non-électrolytes influe sur leurs propriétés chimiques et physiques, telles que la solubilité, la polarité et la conductivité électrique.
En outre, la structure moléculaire des non-électrolytes peut également influencer leur comportement dans les réactions chimiques, ainsi que leur rôle dans les systèmes biologiques.
Propriétés physiques ⁚ point d’ébullition, point de fusion
Les non-électrolytes présentent des propriétés physiques spécifiques, notamment en ce qui concerne leur point d’ébullition et leur point de fusion;
Le point d’ébullition d’un non-électrolyte est la température à laquelle il passe de l’état liquide à l’état gazeux. Cette propriété est influencée par la force des interactions intermoléculaires entre les molécules du non-électrolyte.
Le point de fusion, quant à lui, est la température à laquelle le non-électrolyte passe de l’état solide à l’état liquide. Cette propriété est également liée à la force des interactions intermoléculaires.
Ces propriétés physiques sont importantes pour comprendre le comportement des non-électrolytes dans différents contextes, tels que la séparation des mélanges ou la détermination de leur pureté.
Polarité et forces intermoléculaires
La polarité des non-électrolytes joue un rôle crucial dans les forces intermoléculaires qui les lient.
Les molécules polaires, telles que celles des composés organiques, possèdent une distribution inégale des charges électriques, créant ainsi des moments dipolaires.
Ces moments dipolaires permettent l’établissement de forces intermoléculaires, telles que les forces de van der Waals et les liaisons hydrogène, qui sont essentielles pour la cohésion des molécules.
Ces forces intermoléculaires influencent les propriétés physiques des non-électrolytes, comme leur point d’ébullition et leur point de fusion, ainsi que leur solubilité dans différents solvants.
La compréhension de la polarité et des forces intermoléculaires est donc fondamentale pour étudier les propriétés et le comportement des non-électrolytes.
Caractéristiques des non-électrolytes
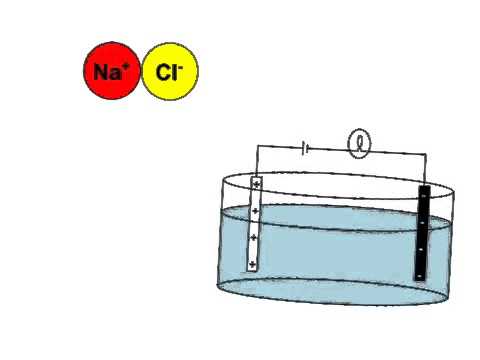
Les non-électrolytes sont caractérisés par leur non-conductivité électrique, leur solubilité variable, et leur absence de réactions chimiques avec les électrolytes.
Non-conductivité électrique
La non-conductivité électrique est l’une des caractéristiques fondamentales des non-électrolytes. Cette propriété est due à l’absence de dissociation en ions lors de la dissolution dans un solvant.
Cela signifie que les non-électrolytes ne peuvent pas conduire l’électricité, car ils ne possèdent pas de charges électriques libres pour transporter les électrons.
Contrairement aux électrolytes, qui ont une conductivité électrique élevée, les non-électrolytes ne permettent pas le passage d’un courant électrique.
Cette propriété est essentielle pour comprendre le comportement des non-électrolytes dans les réactions chimiques et leur rôle dans les systèmes biologiques et environnementaux.
Solubilité dans les solvants organiques et inorganiques
Les non-électrolytes présentent une solubilité variable dans les solvants organiques et inorganiques, dépendant de leurs propriétés chimiques et physiques.
En général, les non-électrolytes sont solubles dans les solvants organiques, tels que l’éthanol, l’acétone ou le benzène, en raison de leurs interactions moléculaires faibles.
En revanche, leur solubilité dans les solvants inorganiques, tels que l’eau ou les acides minéraux, est souvent plus limitée, en raison de leurs propriétés polaires et de leurs forces intermoléculaires.
Cependant, certains non-électrolytes, comme les composés organiques polaires, peuvent être solubles dans les solvants inorganiques, tandis que d’autres, comme les hydrocarbures, sont insolubles dans l’eau.
Absence de réactions chimiques avec les électrolytes
Les non-électrolytes ne réagissent pas chimiquement avec les électrolytes, ce qui signifie qu’ils ne se combinent pas pour former des produits chimiques nouveaux.
Cette propriété est due à la nature covalente des liaisons chimiques au sein des molécules de non-électrolytes, qui ne permet pas la formation d’ions ou de radicaux libres.
Contrairement aux électrolytes, qui peuvent réagir avec d’autres espèces chimiques pour former des produits de réaction, les non-électrolytes restent inchangés dans les réactions chimiques.
Cette absence de réactivité chimique rend les non-électrolytes utiles dans de nombreuses applications, notamment en chimie organique et en biochimie, où ils servent de solvants ou de réactifs inertes.
Exemples de non-électrolytes
Les non-électrolytes comprennent des composés organiques, inorganiques et biochimiques tels que le glucose, le dioxyde de carbone et l’ADN, qui présentent des propriétés chimiques et physiques spécifiques.
Composés organiques ⁚ exemple du glucose
Le glucose est un exemple de composé organique non-électrolyte, présentant une structure moléculaire complexe avec des atomes de carbone, d’hydrogène et d’oxygène.
Il possède des propriétés chimiques et physiques spécifiques, telles que une faible électroconductivité, une solubilité élevée dans l’eau et une polarité modérée due à la présence de groupes hydroxyles.
Le glucose joue un rôle clé dans le métabolisme cellulaire, servant de source d’énergie pour les cellules vivantes.
Ses propriétés chimiques et physiques en font un composé essentiel dans de nombreux processus biologiques et chimiques, notamment dans la biosynthèse des molécules complexes.
Ces caractéristiques font du glucose un exemple représentatif des composés organiques non-électrolytes, illustrant leur importance dans la chimie organique et la biochimie;
Composés inorganiques ⁚ exemple du dioxyde de carbone
Le dioxyde de carbone (CO2) est un exemple de composé inorganique non-électrolyte, présentant une structure moléculaire linéaire avec deux atomes d’oxygène liés à un atome de carbone.
Ce gaz incolore et inodore possède des propriétés chimiques et physiques particulières, telles qu’une faible électroconductivité, une solubilité limitée dans l’eau et une polarité faible.
Le dioxyde de carbone joue un rôle crucial dans de nombreux processus biologiques et chimiques, notamment dans la photosynthèse et la respiration cellulaire.
Ses propriétés chimiques et physiques en font un composé essentiel dans de nombreux domaines, notamment en chimie inorganique, en géologie et en écologie.
Ces caractéristiques font du dioxyde de carbone un exemple représentatif des composés inorganiques non-électrolytes, illustrant leur importance dans la chimie inorganique et la géologie.
Composés biochimiques ⁚ exemple de l’ADN
L’acide désoxyribonucléique (ADN) est un exemple de composé biochimique non-électrolyte, jouant un rôle central dans la transmission de l’information génétique chez les organismes vivants.
Cette molécule complexe présente une structure hélicoïdale double, composée de deux brins d’acide nucléique liés par des liaisons hydrogène.
Les propriétés chimiques de l’ADN, telles que sa faible électroconductivité et sa solubilité dans les solvants polaires, en font un composé non-électrolyte.
Les forces intermoléculaires, notamment les liaisons hydrogène et les forces de van der Waals, jouent un rôle essentiel dans la stabilité de la structure de l’ADN.
Ces caractéristiques font de l’ADN un exemple emblématique des composés biochimiques non-électrolytes, soulignant leur importance dans la biochimie et la biologie moléculaire.
En résumé, les non-électrolytes sont des substances chimiques qui ne se dissociant pas en ions lorsqu’elles sont dissoutes dans un solvant, ce qui les distingue des électrolytes.
Ils présentent des propriétés chimiques spécifiques, telles que la non-conductivité électrique, la solubilité dans les solvants organiques et inorganiques, et l’absence de réactions chimiques avec les électrolytes.
Les exemples de non-électrolytes, tels que le glucose, le dioxyde de carbone et l’ADN, illustrent la diversité de ces composés et leur importance dans différents domaines de la chimie, notamment l’organic, l’inorganic et la biochimie.
La compréhension des propriétés et des caractéristiques des non-électrolytes est essentielle pour les chimistes et les biochimistes pour élucider les mécanismes chimiques et biologiques complexes.
En fin de compte, l’étude des non-électrolytes contribue à l’avancement de nos connaissances en chimie et biochimie, et ouvre de nouvelles perspectives pour la recherche et l’innovation.
Je suis impressionné par l\
J\
Merci pour cette introduction claire et concise sur les non-électrolytes ! J\
Je suis ravie de voir que vous avez abordé le rôle crucial que jouent les non-électrolytes en biochimie.
Cet article est très bien structuré et facile à comprendre même pour ceux qui n\
Je suis impressionnée par la quantité d\
Merci pour cet article très éclairant sur les non-électrolytes ! J\
Cet article est très complet et couvre tous les aspects importants liés aux non-électrolytes.