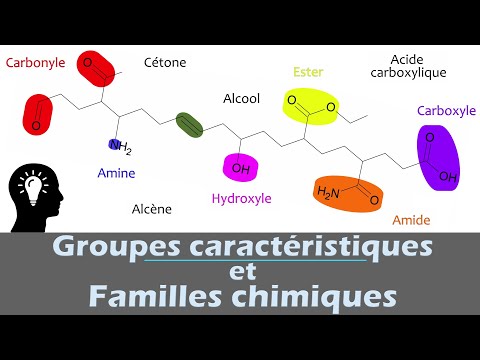
Introduction
Le groupe hydroxyle, fonctionnel essentiel en chimie organique et inorganique, joue un rôle clé dans la détermination des propriétés chimiques et biologiques des molécules.
Définition du groupe hydroxyle
Le groupe hydroxyle est un groupe fonctionnel composé d’un atome d’oxygène lié à un atome d’hydrogène par une liaison covalente. Cette entité chimique est notée -OH et est présente dans de nombreuses molécules organiques et inorganiques.
Ce groupe fonctionnel est caractérisé par une forte polarité due à la grande différence d’électronegativité entre l’oxygène et l’hydrogène. Cette polarité confère au groupe hydroxyle des propriétés chimiques spécifiques qui influencent les réactions acide-base et les interactions moléculaires.
La présence du groupe hydroxyle dans une molécule peut modifier significativement ses propriétés chimiques et biologiques, telles que sa solubilité, son pH et sa stabilité chimique.
I. Structure du groupe hydroxyle
La structure du groupe hydroxyle est caractérisée par une liaison covalente entre l’atome d’oxygène et l’atome d’hydrogène, formant un angle de liaison de 104,5°.
Composition chimique
La composition chimique du groupe hydroxyle est relativement simple, étant composé d’un atome d’oxygène (O) et d’un atome d’hydrogène (H). Cette combinaison forme une molécule neutre, avec une charge électrique nulle.
Cette composition chimique confère au groupe hydroxyle des propriétés spécifiques, telles que sa polarité et son aptitude à former des liaisons hydrogène. L’atome d’oxygène, étant plus électronégatif que l’atome d’hydrogène, attire les électrons de la liaison, créant une légère charge partielle négative.
Liens chimiques
Le groupe hydroxyle est caractérisé par la présence d’une liaison covalente entre l’atome d’oxygène et l’atome d’hydrogène. Cette liaison est formée par la mise en commun d’électrons entre les deux atomes, créant une liaison σ (sigma).
De plus, l’atome d’oxygène peut également former des liaisons avec d’autres atomes, tels que le carbone ou l’azote, pour former des molécules plus complexes. Ces liaisons peuvent être de type covalent ou ionique, selon la nature des atomes impliqués.
Ces liens chimiques jouent un rôle crucial dans la détermination des propriétés chimiques et physiques des molécules contenant le groupe hydroxyle.
Rôle de l’oxygène et de l’hydrogène
L’oxygène et l’hydrogène jouent des rôles distincts mais complémentaires dans le groupe hydroxyle. L’oxygène, avec son électronegativité élevée, attire fortement les électrons de la liaison, créant une polarité importante.
Cela confère au groupe hydroxyle une propriété amphiphile, lui permettant d’interagir avec d’autres molécules polaires ou apolaires. L’hydrogène, quant à lui, contribue à la formation de liaisons hydrogène, essentielles dans les interactions intermoléculaires.
La combinaison de ces deux éléments crée une fonctionnalité unique, qui influe significativement sur les propriétés chimiques et biologiques des molécules qui le portent.
II. Caractéristiques du groupe hydroxyle
Les caractéristiques du groupe hydroxyle influent sur les propriétés chimiques et biologiques des molécules, notamment en termes d’électronegativité, de polarité et de réactivité.
Électronegativité et polarité
L’électronegativité de l’oxygène dans le groupe hydroxyle est élevée, ce qui signifie qu’il attire fortement les électrons de la liaison chimique. Cela entraîne une polarisation de la liaison entre l’oxygène et l’hydrogène, créant un moment dipolaire.
Cette polarité confère au groupe hydroxyle des propriétés spécifiques, telles que la solubilité dans les solvants polaires et la participation à des réactions acide-base. La polarité du groupe hydroxyle influe également sur la stabilité des molécules, en favorisant la formation de liaisons hydrogène avec d’autres molécules.
En outre, l’électronegativité de l’oxygène influence la réactivité du groupe hydroxyle, en facilitant les réactions avec d’autres espèces chimiques. Cette propriété est essentielle pour comprendre les mécanismes des réactions chimiques impliquant le groupe hydroxyle.
Influence sur les propriétés chimiques
Le groupe hydroxyle exerce une influence significative sur les propriétés chimiques des molécules qui le portent. Il participe à la détermination de la solubilité, de la stabilité et de la réactivité des molécules.
En effet, le groupe hydroxyle peut former des liaisons hydrogène avec d’autres molécules, ce qui affecte la solubilité et la stabilité des composés. De plus, il peut intervenir dans les réactions acide-base, influençant ainsi le pH et le niveau d’acidité des solutions.
La présence d’un groupe hydroxyle peut également modifier les propriétés physiques des molécules, telles que la température de fusion et de vaporisation, ainsi que la densité. Enfin, il peut influencer la réactivité des molécules en facilitant ou en inhibant certaines réactions chimiques.
Rôle dans les réactions acide-base
Le groupe hydroxyle joue un rôle crucial dans les réactions acide-base, en raison de sa capacité à donner ou à accepter des protons (H+).
En tant que donneur de protons, le groupe hydroxyle peut se comporter comme un acide, libérant des ions H+ dans une solution aqueuse. Cela contribue à augmenter le pH et à diminuer le niveau d’acidité de la solution.
Inversement, le groupe hydroxyle peut également agir comme une base, acceptant des protons et formant des ions hydroxyde (OH-). Cette propriété permet aux molécules contenant un groupe hydroxyle de participer à des réactions de neutralisation avec des acides forts.
III. Propriétés du groupe hydroxyle
Les propriétés du groupe hydroxyle, telles que le pH, la solubilité et la stabilité chimique, influencent grandement le comportement des molécules qui le possèdent.
pH et niveau d’acidité
Le groupe hydroxyle est impliqué dans la régulation du pH et du niveau d’acidité des solutions. En raison de sa capacité à donner ou à recevoir des protons, il participe aux réactions acide-base et influe sur le pH des solutions.
Les molécules portant un groupe hydroxyle peuvent être classées comme acides ou basiques, en fonction de leur capacité à donner ou à recevoir des protons. Les groupes hydroxyle peuvent également contribuer à la formation de liaisons hydrogène, ce qui affecte la solubilité et la stabilité chimique des molécules.
En chimie organique, les groupes hydroxyle sont souvent impliqués dans la formation de composés acides, tels que les acides carboxyliques et les alcools, qui ont des propriétés chimiques et biologiques spécifiques.
Solubilité dans les solvants
La présence d’un groupe hydroxyle dans une molécule influence sa solubilité dans différents solvants. Les molécules portant un groupe hydroxyle sont souvent polaires et peuvent former des liaisons hydrogène avec les molécules de solvant, ce qui facilite leur solubilité dans les solvants polaires tels que l’eau.
Les groupes hydroxyle peuvent également contribuer à la solubilité dans les solvants organiques, tels que les éthers et les cétones, en formant des liaisons dipôle-dipôle ou des liaisons hydrogène avec les molécules de solvant.
La solubilité des molécules portant un groupe hydroxyle dépend donc de la nature du solvant et de la force des interactions entre les molécules de soluté et de solvant.
Stabilité chimique
La stabilité chimique des molécules portant un groupe hydroxyle est influencée par la présence de cet groupe fonctionnel. Le groupe hydroxyle peut être impliqué dans des réactions chimiques telles que les réactions d’oxydation, de réduction et d’hydrolyse.
Cependant, la présence d’un groupe hydroxyle peut également conférer une certaine stabilité chimique à la molécule, en raison de la forte liaison covalente entre l’oxygène et l’hydrogène.
De plus, le groupe hydroxyle peut participer à la formation de liaisons hydrogène intramoléculaires, ce qui renforce la stabilité de la molécule et empêche la rotation libre autour de la liaison simple.
IV. Exemples de molécules contenant un groupe hydroxyle
Les molécules contenant un groupe hydroxyle sont nombreuses et variées, allant des alcools et des phénols en chimie organique aux oxydes et aux hydroxydes en chimie inorganique.
Exemples en chimie organique
En chimie organique, les molécules contenant un groupe hydroxyle sont très courantes et jouent un rôle essentiel dans de nombreux processus biologiques.
Les alcools, tels que l’éthanol et le méthanol, sont des exemples classiques de molécules organiques portant un groupe hydroxyle.
Les phénols, tels que le phénol et la créosote, sont également des composés organiques importants qui contiennent un groupe hydroxyle.
Ces molécules sont souvent impliquées dans des réactions d’oxydoréduction et de substitution, et leur groupe hydroxyle joue un rôle clé dans ces processus;
De plus, les groupes hydroxyle sont souvent impliqués dans la formation de liaisons hydrogène, qui sont essentielles pour la structure et la fonction des macromolécules biologiques.
Exemples en chimie inorganique
En chimie inorganique, les molécules contenant un groupe hydroxyle sont moins courantes que dans la chimie organique, mais tout aussi importantes.
Les hydroxydes, tels que l’hydroxyde de sodium (NaOH) et l’hydroxyde de calcium (Ca(OH)2), sont des exemples de composés inorganiques portant un groupe hydroxyle.
Ces molécules sont souvent utilisées comme bases fortes dans les réactions chimiques et jouent un rôle clé dans la neutralisation des acides.
De plus, les groupes hydroxyle peuvent être présents dans les minéraux, tels que la kaolinite et la gibbsite, qui sont des exemples de composés inorganiques naturels contenant un groupe hydroxyle.
Ces molécules inorganiques sont essentielles pour de nombreux processus géologiques et industriels.
Exemples en biochimie
En biochimie, le groupe hydroxyle est présent dans de nombreuses molécules biologiquement actives, telles que les sucres, les acides aminés et les lipides.
Les sucres, tels que le glucose et le fructose, contiennent un groupe hydroxyle qui joue un rôle clé dans leur métabolisme.
Certains acides aminés, tels que la sérine et la thréonine, possèdent un groupe hydroxyle qui est essentiel pour leur fonctionnement biologique.
Les lipides, tels que les phospholipides, contiennent également des groupes hydroxyle qui leur confèrent des propriétés amphiphiles.
Ces molécules biochimiques sont essentielles pour de nombreux processus biologiques, notamment la régulation du métabolisme et la transmission des signaux cellulaires.
En résumé, le groupe hydroxyle est un fonctionnel essentiel en chimie, caractérisé par une forte polarité et une grande influence sur les propriétés chimiques et biologiques.
Récapitulation des caractéristiques du groupe hydroxyle
En résumant les propriétés du groupe hydroxyle, nous pouvons souligner son importance dans la détermination des propriétés chimiques et biologiques des molécules. En effet, ce groupe fonctionnel est caractérisé par une forte polarité due à l’électronegativité de l’oxygène, ce qui influence grandement les réactions acide-base et les interactions moléculaires. De plus, le groupe hydroxyle joue un rôle clé dans la solubilité des molécules dans les solvants polaires et non polaires. Enfin, sa présence est essentielle dans de nombreuses molécules biologiquement actives, telles que les sucres, les acides aminés et les lipides. Ces caractéristiques font du groupe hydroxyle un élément crucial en chimie organique, inorganique et biochimie.