Introduction
L’équilibre vapeur-liquide est un concept fondamental en thermodynamique et en génie chimique, régissant les transformations de phase entre l’état liquide et gazeux pour les substances pures et les mélanges.
Contexte et importance de l’équilibre vapeur-liquide
L’équilibre vapeur-liquide est une notion essentielle en thermodynamique et en génie chimique, car il permet de comprendre et de prévoir les transformations de phase qui ont lieu dans de nombreux processus physiques et chimiques. Dans l’industrie chimique, la maîtrise de l’équilibre vapeur-liquide est cruciale pour la conception et l’optimisation des procédés de séparation, de purification et de transformation des produits chimiques.
Cette notion joue également un rôle clé dans la compréhension des phénomènes naturels, tels que la formation des nuages, la condensation de l’eau et les cycles de l’eau dans l’environnement. De plus, l’équilibre vapeur-liquide est essentiel pour la sécurité des opérations industrielles, car il permet de prévenir les accidents liés à la formation de vapeurs explosives ou toxiques.
En résumé, l’équilibre vapeur-liquide est une notion fondamentale qui a des implications importantes dans de nombreux domaines, allant de la génie chimique à l’environnement et à la sécurité industrielle.
I. Équilibre vapeur-liquide des substances pures
L’équilibre vapeur-liquide des substances pures est décrit par la relation entre la pression de vapeur et la température, caractérisant les propriétés thermodynamiques des substances purs.
Définition et principes de base
L’équilibre vapeur-liquide est un état thermodynamique où la phase vapeur et la phase liquide d’une substance pure coexistent en équilibre, sans apport ni sortie de matière.
Ce phénomène est régi par les lois de la thermodynamique, qui définissent les relations entre la pression, la température et le volume des systèmes.
Les principes de base de l’équilibre vapeur-liquide sont ⁚
- le principe de l’équilibre thermodynamique, qui postule que les systèmes tendent vers un état d’équilibre;
- la loi de conservation de la masse, qui stipule que la quantité de matière est constante;
- le principe de l’énergie minimale, qui définit l’état d’équilibre comme celui qui minimise l’énergie du système.
Ces principes fondamentaux permettent de comprendre et de prévoir le comportement des substances pures en équilibre vapeur-liquide.
Pression de vapeur et point d’ébullition
La pression de vapeur d’une substance pure est la pression exercée par la vapeur en équilibre avec la phase liquide à une température donnée.
Cette grandeur est caractéristique de chaque substance et varie en fonction de la température, augmentant lorsque la température augmente.
Le point d’ébullition est la température à laquelle la pression de vapeur d’une substance pure est égale à la pression atmosphérique.
À ce point, la vapeur se forme à la surface du liquide et le système est en équilibre vapeur-liquide.
La pression de vapeur et le point d’ébullition sont deux grandeurs intimement liées, permettant de caractériser les propriétés thermodynamiques des substances pures.
La connaissance de ces grandeurs est essentielle pour comprendre et prévoir le comportement des substances pures en équilibre vapeur-liquide.
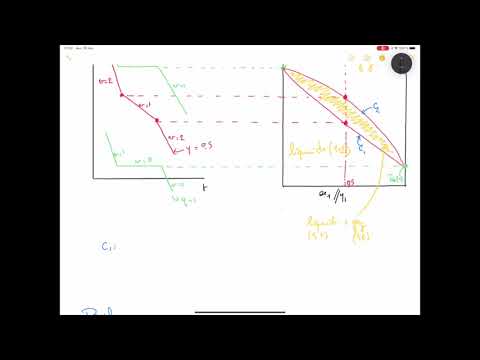
Diagramme de phase et équilibre thermodynamique
Le diagramme de phase est une représentation graphique de l’équilibre vapeur-liquide d’une substance pure, montrant les régions de stabilité des phases liquide et vapeur.
Ce diagramme est caractérisé par trois courbes ⁚ la courbe de fusion, la courbe de vaporisation et la courbe de sublimation.
L’équilibre thermodynamique est atteint lorsqu’il y a égalité des potentiels chimiques des phases liquide et vapeur.
À cette condition, la pression de vapeur est égale à la pression du système et le système est en équilibre vapeur-liquide.
Le diagramme de phase permet de visualiser les changements de phase qui surviennent lors de variations de température et de pression.
Il est ainsi possible de déterminer les conditions d’équilibre vapeur-liquide pour une substance pure et de prévoir son comportement en fonction des conditions opératoires.
II. Équilibre vapeur-liquide des mélanges
L’équilibre vapeur-liquide des mélanges est une extension du concept aux systèmes multicomposants, où les interactions entre les espèces chimiques influent sur les propriétés de vapeur et de liquide.
Raoult’s law et Henry’s law ⁚ les lois fondamentales
Raoult’s law et Henry’s law sont deux lois fondamentales qui gouvernent l’équilibre vapeur-liquide des mélanges. La loi de Raoult décrit le comportement des solutions idéales, où la pression de vapeur d’un mélange est la somme des pressions de vapeur des composants purs, pondérées par leur fraction molaire. Cette loi est valable pour les mélanges de composés chimiquement semblables, tels que des isomères ou des composés organiques.
D’autre part, la loi de Henry décrit le comportement des gaz dans les liquides, où la solubilité d’un gaz dans un liquide est proportionnelle à la pression partielle du gaz au-dessus du liquide. Cette loi est particulièrement utile pour décrire les propriétés de vapeur des mélanges contenant des gaz dissous.
Ces deux lois fondamentales permettent de comprendre et de prévoir le comportement des mélanges en équilibre vapeur-liquide, ce qui est essentiel pour de nombreuses applications en génie chimique et en industrie chimique.
Solutions idéales et non idéales ⁚ les coefficients d’activité
Les solutions idéales sont des mélanges qui obéissent à la loi de Raoult, où les interactions entre les molécules des composants sont négligeables. Cependant, dans la plupart des cas, les solutions réelles sont non idéales, ce qui signifie que les interactions entre les molécules influencent le comportement du mélange.
Pour prendre en compte ces interactions, il est nécessaire d’introduire les coefficients d’activité, qui représentent la deviation par rapport au comportement idéal. Les coefficients d’activité sont des paramètres thermodynamiques qui dépendent de la composition du mélange et de la température.
Les coefficients d’activité sont utilisés pour corriger les pressions de vapeur calculées à l’aide de la loi de Raoult, permettant ainsi d’obtenir des résultats plus précis pour les mélanges non idéaux. Cette approche est particulièrement importante pour les applications en génie chimique, où la compréhension précise de l’équilibre vapeur-liquide est cruciale pour la conception et l’optimisation des processus.
Applications en génie chimique ⁚ les colonnes de distillation
Les colonnes de distillation sont des équipements clés en génie chimique, permettant la séparation des mélanges en leurs composants individuels. L’équilibre vapeur-liquide joue un rôle central dans le fonctionnement de ces colonnes, car il détermine la séparation efficace des composants.
En effet, la distillation est basée sur la différence de pression de vapeur entre les composants d’un mélange. En faisant varier la température et la pression dans la colonne, il est possible de créer des conditions d’équilibre vapeur-liquide favorisant la séparation des composants.
Les ingénieurs chimistes utilisent les lois de l’équilibre vapeur-liquide, telles que la loi de Raoult et la loi de Henry, pour concevoir et optimiser les colonnes de distillation. Ces équipements sont essentiels dans de nombreux processus industriels, tels que la production de produits pétroliers, la fabrication de produits chimiques et la purification de substances pharmaceutiques.
III. Applications pratiques de l’équilibre vapeur-liquide
L’équilibre vapeur-liquide a de nombreuses applications pratiques dans divers domaines, notamment la distillation, la séparation de mélanges, la purification de substances et la conception de procédés industriels.
La distillation fractionnée et la séparation des mélanges
La distillation fractionnée est une technique couramment utilisée pour séparer les mélanges de substances pures en fonction de leurs points d’ébullition respectifs. Cette méthode repose sur le principe de l’équilibre vapeur-liquide, où les composants du mélange sont vaporisés à des températures différentes, permettant ainsi leur séparation.
La distillation fractionnée est utilisée dans de nombreux domaines, tels que la pétrochimie, la pharmacie et l’agroalimentaire, pour produire des substances pures ou des mélanges à composition définie. Les colonnes de distillation, équipées de plaques ou de remplissages spécifiques, permettent d’optimiser la séparation des mélanges en fonction de leurs propriétés thermodynamiques.
Cette technique est particulièrement utile pour séparer les mélanges complexes, où les composants ont des points d’ébullition voisins, ou pour produire des substances à haute pureté. La maîtrise de l’équilibre vapeur-liquide est donc essentielle pour concevoir et optimiser les procédés de distillation fractionnée.
L’importance de l’équilibre vapeur-liquide en industrie chimique
L’équilibre vapeur-liquide joue un rôle crucial dans l’industrie chimique, car il conditionne la conception et la mise en œuvre de nombreux procédés de production. En effet, la maîtrise de l’équilibre vapeur-liquide permet de contrôler les réactions chimiques, les séparations et les purifications, qui sont des étapes clés dans la fabrication de produits chimiques.
Les industriels chimiques doivent prendre en compte les propriétés thermodynamiques des substances pures et des mélanges pour concevoir des procédés efficaces et économiques. L’équilibre vapeur-liquide influe également sur la sécurité des procédés, car la pression de vapeur et la température peuvent avoir des conséquences importantes sur la stabilité des réacteurs et des équipements.
En résumé, la compréhension de l’équilibre vapeur-liquide est essentielle pour assurer la qualité, la sécurité et l’efficacité des procédés chimiques, et pour développer de nouveaux produits et procédés innovants.
Exemples concrets d’applications dans divers domaines
L’équilibre vapeur-liquide a de nombreuses applications concrètes dans divers domaines, notamment ⁚
- la production de carburants, où la distillation fractionnée permet de séparer les différents composants du pétrole,
- l’industrie pharmaceutique, où l’équilibre vapeur-liquide est utilisé pour purifier et séparer les principes actifs,
- la production d’aliments, où la lyophilisation et la déshydratation dépendent de l’équilibre vapeur-liquide,
- l’environnement, où l’étude de l’équilibre vapeur-liquide est essentielle pour comprendre les phénomènes de pollution atmosphérique.
Ces exemples illustrent l’importance de l’équilibre vapeur-liquide dans la conception et la mise en œuvre de procédés et de technologies clés dans différents domaines.
Cette compréhension approfondie de l’équilibre vapeur-liquide permet de développer de nouvelles applications et de résoudre des problèmes complexes dans ces domaines.