Introduction
L’électronégativité est une propriété fondamentale des atomes, qui définit leur capacité à attirer les électrons dans les liaisons chimiques, influençant ainsi les propriétés chimiques des molécules.
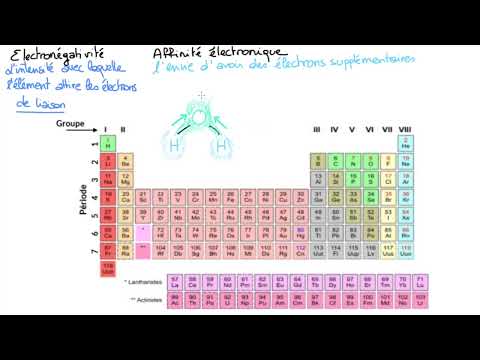
Définition de l’électronégativité
L’électronégativité est une mesure de la tendance d’un atome à attirer les électrons vers lui-même dans une liaison chimique. Cette propriété est liée à la structure atomique de l’atome, en particulier à la configuration de ses orbitales et à la charge nucléaire. L’électronégativité est une force attractive qui s’exerce entre les électrons et le noyau de l’atome, et qui influe sur la formation des liaisons chimiques, qu’elles soient covalentes ou ioniques. Elle est également liée à la polarité des molécules et aux potentiels chimiques des éléments.
Importance de l’électronégativité en chimie
L’électronégativité joue un rôle crucial en chimie, car elle permet de comprendre et de prédire les propriétés chimiques des éléments chimiques et des molécules. En effet, l’électronégativité influence la formation des liaisons chimiques, la polarité des molécules et les potentiels chimiques des éléments. Cela signifie que l’électronégativité est essentielle pour comprendre les réactions chimiques, les propriétés physiques et chimiques des substances, ainsi que leur comportement dans différents environnements. De plus, l’électronégativité est utilisée pour identifier les atomes qui ont tendance à former des liaisons covalentes ou ioniques, ce qui est essentiel pour la compréhension de la chimie des composés.
Les échelles d’électronégativité
Les échelles d’électronégativité sont des systèmes de classement qui permettent de définir et de comparer les valeurs d’électronégativité des éléments chimiques de manière quantitative.
L’échelle de Pauling
L’échelle de Pauling est l’une des échelles d’électronégativité les plus couramment utilisées. Elle a été développée par Linus Pauling en 1932 et attribue des valeurs d’électronégativité comprises entre 0 et 4,0 aux éléments chimiques. Cette échelle est basée sur la mesure de l’énergie de liaison entre les atomes dans les molécules diatomiques. Les valeurs d’électronégativité sur l’échelle de Pauling sont définies en fonction de la différence d’énergie de liaison entre un atome et un atome de référence, généralement l’hydrogène. Les éléments ayant une forte électronégativité, tels que le fluor et l’oxygène, ont des valeurs élevées sur cette échelle, tandis que les éléments ayant une faible électronégativité, tels que le césium et le francium, ont des valeurs basses.
L’échelle d’Allred-Rochow
L’échelle d’Allred-Rochow est une autre échelle d’électronégativité qui a été développée par Alfred Allred et Eugene Rochow en 1958. Cette échelle est basée sur la mesure de la polarité des liaisons chimiques et attribue des valeurs d’électronégativité comprises entre 0,0 et 3,9 aux éléments chimiques. Les valeurs sur cette échelle sont définies en fonction de la charge effective des nucléaire des atomes et de la taille des orbitale des électrons. L’échelle d’Allred-Rochow est considérée comme plus précise que l’échelle de Pauling, notamment pour les éléments transitionnels et les éléments lourds. Elle est souvent utilisée pour étudier les propriétés chimiques des molécules complexes.
Comparaison des échelles d’électronégativité
Les différentes échelles d’électronégativité, telles que celles de Pauling et d’Allred-Rochow, présentent des similitudes et des différences. Toutes deux attribuent des valeurs d’électronégativité aux éléments chimiques, mais elles diffèrent dans leur méthode de calcul et leur plage de valeurs. L’échelle de Pauling est plus simple et plus largement utilisée, tandis que l’échelle d’Allred-Rochow est considérée comme plus précise. Les valeurs d’électronégativité obtenues avec ces deux échelles ne sont pas directement comparables, mais elles peuvent être corrélées. Il est important de comprendre les limitations et les avantages de chaque échelle pour choisir la bonne méthode pour une étude particulière des propriétés chimiques des molécules.
Variations de l’électronégativité
L’électronégativité varie en fonction de la période et de la famille des éléments chimiques, influencée par la nucléaire et l’orbitale des atomes.
Influence de la période sur l’électronégativité
L’influence de la période sur l’électronégativité est liée à la taille de l’atome et à la distance entre le noyau et les électrons. Au sein d’une même famille, l’électronégativité augmente lorsque l’on descend dans la période, car les électrons sont plus éloignés du noyau et sont donc plus fortement attirés par lui. Cela signifie que les éléments chimiques de la même famille mais de périodes supérieures ont une électronégativité plus faible. Par exemple, l’électronégativité du fluor (F) est plus élevée que celle du chlore (Cl), car le fluor se trouve dans une période inférieure.
Influence de la famille sur l’électronégativité
L’influence de la famille sur l’électronégativité est liée à la configuration électronique des atomes. Les éléments appartenant à la même famille, tels que les halogènes ou les alcalins, ont des configurations électroniques similaires, ce qui affecte leur électronégativité. Les éléments de la famille des halogènes, par exemple, ont une électronégativité élevée en raison de leur forte tendance à gagner des électrons pour compléter leur couche de valence. Inversement, les éléments de la famille des alcalins ont une électronégativité faible en raison de leur tendance à perdre des électrons pour acquérir une configuration électronique stable.
Facteurs influençant l’électronégativité
Plusieurs facteurs influencent l’électronégativité des éléments chimiques, notamment la charge nucléaire, la taille de l’atome, la configuration électronique et la présence de liaisons chimiques. La charge nucléaire influence l’attraction exercée sur les électrons, tandis que la taille de l’atome affecte la distance entre le noyau et les électrons. La configuration électronique, quant à elle, détermine la répartition des électrons dans les orbitales et influence ainsi l’électronégativité. Enfin, la présence de liaisons chimiques peut modifier l’électronégativité en raison de la redistribution des électrons au sein de la molécule.
L’utilité de l’électronégativité
L’électronégativité est essentielle pour comprendre les propriétés chimiques et les liaisons chimiques entre les atomes, permettant de prédire les comportements chimiques des molécules.
Détermination des propriétés chimiques
La connaissance de l’électronégativité est cruciale pour déterminer les propriétés chimiques des éléments chimiques. En effet, elle permet de prévoir la formation de liaisons chimiques, notamment covalentes ou ioniques, en fonction de la différence d’électronégativité entre les atomes impliqués.
Par exemple, une grande différence d’électronégativité entraîne la formation d’une liaison ionique, tandis qu’une petite différence conduit à une liaison covalente. De plus, l’électronégativité influence la polarité des molécules, ce qui affecte leurs propriétés physiques et chimiques.
Prédiction des liaisons chimiques
La connaissance de l’électronégativité permet de prédire la formation de liaisons chimiques entre les atomes. En effet, lorsque la différence d’électronégativité entre deux atomes est importante, une liaison ionique se forme, tandis que lorsque la différence est faible, une liaison covalente est plus probable.
De plus, l’électronégativité influe sur la polarité des molécules, ce qui affecte la formation de liaisons chimiques. Les orbitales atomiques sont également influencées par l’électronégativité, ce qui permet de comprendre les mécanismes de formation des liaisons chimiques.
Cette prédiction est essentielle en chimie, car elle permet de comprendre les propriétés chimiques des molécules et de prévoir leur comportement.
Exemples et applications
L’électronégativité a des applications importantes dans la compréhension des propriétés chimiques des éléments chimiques et des molécules, ainsi que dans la prédiction de leurs réactions chimiques;
Exemples d’éléments chimiques avec une forte électronégativité
Certains éléments chimiques présentent une forte électronégativité, comme le fluor (F), l’oxygène (O), l’azote (N) et le chlore (Cl). Ces éléments ont tendance à attirer fortement les électrons vers eux-mêmes, formant des liaisons chimiques très polaires.
Ces éléments sont souvent très réactifs et forment des composés très stables, comme les fluorures et les oxydes. La forte électronégativité de ces éléments leur permet de former des liaisons covalentes très fortes avec d’autres éléments, comme l’hydrogène ou le carbone.
Ces propriétés rendent ces éléments très utiles dans de nombreux domaines, tels que la chimie organique, la chimie inorganique et la biologie.
Applications de l’électronégativité en chimie organique et inorganique
L’électronégativité joue un rôle crucial dans la compréhension des propriétés et du comportement des molécules en chimie organique et inorganique.
En chimie organique, l’électronégativité est utilisée pour prédire la réactivité des molécules et la formation de liaisons chimiques. Elle permet de comprendre les mécanismes de réaction et de concevoir de nouvelles molécules avec des propriétés spécifiques.
En chimie inorganique, l’électronégativité est importante pour la synthèse de composés inorganiques, tels que les oxydes et les fluorures, qui ont des applications variées dans les domaines de la catalyse, de l’électronique et de la médecine.