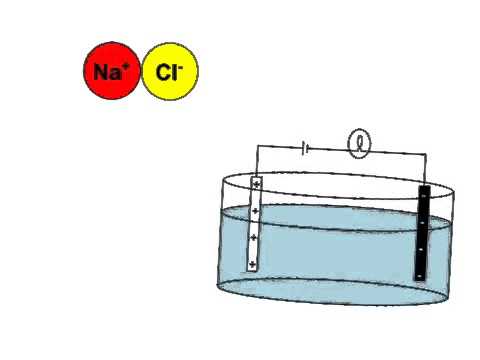
Introduction
Les électrolytes faibles jouent un rôle crucial dans la compréhension des réactions chimiques, notamment en ce qui concerne l’acid-base chemistry, les équilibres et les pH․
Définition des électrolytes
Les électrolytes sont des substances qui, lorsqu’elles sont dissoutes dans un solvant, tel que l’eau, se dissocient en ions porteurs de charge électrique․
Ces ions libres permettent à la solution de conduire l’électricité․
On distingue deux types d’électrolytes ⁚ les électrolytes forts et les électrolytes faibles;
Les électrolytes forts, tels que les sels et les bases fortes, se dissocient complètement en ions, tandis que les électrolytes faibles, tels que les acides faibles et les bases faibles, ne se dissocient que partiellement․
Cette propriété de dissociation est à la base de leur rôle dans les réactions chimiques et les équilibres․
La compréhension des électrolytes et de leurs propriétés est essentielle pour étudier les phénomènes chimiques et les processus biologiques․
Importance des électrolytes faibles en chimie
Les électrolytes faibles jouent un rôle crucial en chimie, notamment en acid-base chemistry․
Ils permettent de comprendre les mécanismes des réactions chimiques, les équilibres et les pH․
En effet, les électrolytes faibles influent sur la concentration des ions H+ et OH-, ce qui affecte les pH et les équilibres chimiques․
Ils sont également impliqués dans les processus biologiques, tels que la régulation du pH sanguin et la transmission des signaux nerveux․
De plus, les électrolytes faibles sont utilisés dans de nombreuses applications industrielles, telles que la production de médicaments, de produits chimiques et de matériaux․
L’étude des électrolytes faibles est donc essentielle pour comprendre et maîtriser les phénomènes chimiques et biologiques․
Le concept d’électrolytes faibles
Les électrolytes faibles sont des composés ioniques qui se dissocient partiellement en solution, libérant ainsi des ions qui influent sur les propriétés chimiques et physiques de la solution;
Définition et caractéristiques
Les électrolytes faibles sont des substances qui, lorsqu’elles sont dissoutes dans un solvant, tels que l’eau, se dissocient partiellement en ions․ Cette dissociation est incomplète, contrairement aux électrolytes forts qui se dissocient complètement․
Ces composés ioniques présentent des propriétés spécifiques, telles que la capacité à conduire l’électricité, mais de manière moins efficace que les électrolytes forts․ Les électrolytes faibles ont également une influence sur les pH des solutions, mais dans une moindre mesure que les électrolytes forts․
Ils sont caractérisés par une constante de dissociation (Kd) qui mesure l’équilibre entre les espèces ionisées et non ionisées․ Cette constante varie en fonction de la force de l’électrolyte et de la température․
Différence avec les électrolytes forts
Les électrolytes faibles se distinguent des électrolytes forts par leur capacité de dissociation incomplète en ions․ Alors que les électrolytes forts se dissocient complètement en ions, les électrolytes faibles ne le font que partiellement․
Cette différence de comportement a des conséquences importantes sur les propriétés des solutions électrolytiques․ Les électrolytes forts sont capables de conduire l’électricité de manière efficace, tandis que les électrolytes faibles le font de manière moins efficace․
De plus, les électrolytes forts ont une influence plus grande sur les pH des solutions que les électrolytes faibles․ Cela est dû à la présence d’ions libres qui peuvent réagir avec d’autres espèces chimiques․
Caractéristiques des électrolytes faibles
Les électrolytes faibles sont caractérisés par une dissociation incomplète, une faible conductivité électrique et une influence modérée sur les pH des solutions․
Ionisation et dissociation
L’ionisation et la dissociation sont deux processus clés qui caractérisent les électrolytes faibles․ L’ionisation désigne la formation d’ions à partir d’une molécule neutre, tandis que la dissociation correspond à la séparation d’ions préexistants․ Dans le cas des électrolytes faibles, la dissociation est incomplète, ce qui signifie que seule une partie des molécules se dissocie en ions․
Cette propriété est à l’origine de la faible conductivité électrique des électrolytes faibles, car il y a moins d’ions libres pour conduire le courant électrique․ De plus, la dissociation incomplète affecte également l’équilibre chimique et les pH des solutions, ce qui a des implications importantes en acid-base chemistry․
Constante de dissociation
La constante de dissociation (Kd) est une mesure de la tendance d’un électrolyte faible à se dissocier en ions․ Elle est définie comme le rapport entre la concentration des ions produits et la concentration de la forme non dissociée de l’électrolyte․
Kd est une valeur importante qui permet de quantifier la force d’un électrolyte faible․ Plus Kd est élevée, plus l’électrolyte est susceptible de se dissocier et plus il est fort․ Inversement, plus Kd est faible, plus l’électrolyte est susceptible de rester sous forme non dissociée et plus il est faible․
La constante de dissociation est essentielle pour comprendre le comportement des électrolytes faibles dans les solutions et pour prédire les équilibres chimiques et les pH․
Influence sur les pH
L’influence des électrolytes faibles sur les pH est complexe et dépend de plusieurs facteurs, tels que la force de l’électrolyte, la concentration de l’électrolyte et la présence d’autres espèces chimiques dans la solution․
Lorsqu’un électrolyte faible se dissocie, il libère des ions H+ ou OH-, ce qui affecte le pH de la solution․ Les électrolytes faibles acides, tels que l’acide carbonique, augmentent la concentration d’ions H+ et abaissent le pH, tandis que les électrolytes faibles basiques, tels que l’ammoniaque, augmentent la concentration d’ions OH- et élèvent le pH․
La compréhension de l’influence des électrolytes faibles sur les pH est essentielle pour contrôler les réactions chimiques et les processus biologiques qui dépendent du pH․
Exemples d’électrolytes faibles
Les électrolytes faibles comprennent notamment les acides faibles tels que l’acide carbonique, l’acide citrique et l’acide lactique, ainsi que les bases faibles comme l’ammoniaque et l’hydroxide d’ammonium․
Acides faibles
Les acides faibles sont des molécules qui ne se dissocient pas complètement en ions lorsqu’elles sont dissoutes dans un solvant, généralement l’eau․ Ils ont une faible constante de dissociation, ce qui signifie qu’ils ne libèrent pas tous leurs ions H+ lors de la dissociation․
Ces acides faibles sont importants en chimie organique et inorganique car ils influencent les pH et les équilibres des réactions chimiques․ Les exemples d’acides faibles incluent l’acide carbonique (H2CO3), l’acide citrique (C6H8O7), l’acide lactique (C3H6O3) et l’acide oxalique (C2H2O4)․
Ces acides faibles jouent un rôle clé dans de nombreuses applications, notamment en biochimie, en pharmacologie et dans l’industrie alimentaire․
Bases faibles
Les bases faibles sont des molécules qui ne se dissocient pas complètement en ions lorsqu’elles sont dissoutes dans un solvant, généralement l’eau․ Elles ont une faible constante de dissociation, ce qui signifie qu’elles ne capturent pas tous les ions H+ lors de la dissociation․
Ces bases faibles sont importantes en chimie organique et inorganique car elles influencent les pH et les équilibres des réactions chimiques․ Les exemples de bases faibles incluent l’ammoniac (NH3), la triméthylamine ((CH3)3N) et la pyridine (C5H5N)․
Ces bases faibles jouent un rôle clé dans de nombreuses applications, notamment en biochimie, en pharmacologie et dans l’industrie chimique․ Elles sont également utilisées comme catalyseurs ou comme agents de complexation dans certaines réactions chimiques․
Rôle des électrolytes faibles en chimie
Les électrolytes faibles jouent un rôle crucial dans la régulation des pH, la catalyse de réactions chimiques et la formation de complexes, influençant ainsi l’ensemble des réactions chimiques et biochimiques․
Réactions chimiques et équilibres
Les électrolytes faibles participent à la modulation des réactions chimiques en influençant les équilibres chimiques․ En effet, leur ionisation incomplète entraîne une modification de la concentration des ions en solution, ce qui affecte les constantes d’équilibre․
Cette propriété est particulièrement importante dans les réactions d’oxydoréduction, où les électrolytes faibles peuvent agir comme des catalyseurs ou des inhibiteurs․ De plus, les électrolytes faibles peuvent former des complexes avec d’autres espèces chimiques, modifiant ainsi leur réactivité et leur cinétique․
En conséquence, la compréhension des électrolytes faibles est essentielle pour prévoir et contrôler les réactions chimiques, notamment dans les systèmes biologiques où les équilibres chimiques sont souvent délicats․
Importance en acid-base chemistry
Les électrolytes faibles jouent un rôle central en acid-base chemistry, car ils influent sur la force des acides et des bases․
En effet, les électrolytes faibles tels que les acides faibles et les bases faibles ont une influence significative sur les pH des solutions․
Ils participent également à la régulation des équilibres acide-base, en modulant la concentration des ions hydrogène et hydroxyle․
De plus, les électrolytes faibles peuvent former des complexes avec d’autres espèces chimiques, ce qui affecte leur acidité ou basicité․
Cette propriété est particulièrement importante dans les systèmes biologiques, où les équilibres acide-base sont souvent délicats et doivent être strictement régulés․