Introduction
La solution concentrée est un type de solution qui contient une grande quantité de soluté dissous dans un volume limité de solvant‚ ce qui en fait une préparation très utile en chimie.
Définition de la solution concentrée
Une solution concentrée est une préparation liquide qui contient une grande quantité de soluté dissous dans un volume limité de solvant. Cette définition implique que la solution concentrée a une forte teneur en soluté‚ ce qui signifie que le rapport entre la quantité de soluté et la quantité de solvant est élevé.
Cette définition est importante car elle permet de distinguer les solutions concentrées des solutions diluées‚ qui ont une faible teneur en soluté. Les solutions concentrées sont souvent utilisées comme STOCK pour préparer d’autres solutions plus diluées‚ ce qui facilite la manipulation et la conservation des substances chimiques.
En résumé‚ la définition de la solution concentrée repose sur la présence d’une grande quantité de soluté dissous dans un volume limité de solvant‚ ce qui en fait une préparation très utile en chimie.
Caractéristiques de la solution concentrée
Les solutions concentrées se caractérisent par une forte teneur en soluté‚ une viscosité élevée et une pression osmotique importante‚ ce qui les rend utiles pour la préparation de solutions plus diluées.
Formule de la solution concentrée
La formule de la solution concentrée permet de définir la quantité de soluté présente dans un volume donné de solvant. La concentration d’une solution est généralement exprimée en fonction de la masse de soluté par unité de volume de solvant.
La formule de la concentration molaire (M) est la suivante ⁚
M = n/V
Où ⁚
- n est le nombre de moles de soluté
- V est le volume de solvant en litres
Cette formule permet de calculer la concentration d’une solution concentrée en connaissant la masse de soluté et le volume de solvant utilisés.
Par exemple‚ si l’on ajoute 200 grammes de sucre à 1 litre d’eau‚ la concentration de la solution est de 2 moles par litre (M = 2 mol/L).
Unités de concentration
Les unités de concentration sont essentielles pour définir la quantité de soluté présente dans une solution. Les unités de concentration les plus couramment utilisées sont ⁚
- La molarité (M) ⁚ exprimée en moles par litre (mol/L)
- La normalité (N) ⁚ exprimée en équivalents par litre (eq/L)
- La molalité (m) ⁚ exprimée en moles par kilogramme de solvant (mol/kg)
- La fraction molaire (x) ⁚ exprimée en moles de soluté par mole de solvant
- La concentration massique (ρ) ⁚ exprimée en grammes par litre (g/L)
Ces unités de concentration permettent de comparer les concentrations de différentes solutions et de déterminer la quantité de soluté nécessaire pour atteindre une concentration spécifique.
Il est important de choisir l’unité de concentration appropriée en fonction de la méthode de préparation de la solution et de l’objectif expérimental.
Exemples de solutions concentrées
Les solutions concentrées sont très courantes dans divers domaines‚ notamment en chimie‚ en pharmacie et en industrie. Voici quelques exemples ⁚
- L’acide sulfurique (H2SO4) à 98% est une solution concentrée utilisée dans la production de produits chimiques et de matériaux de construction.
- La soude caustique (NaOH) à 50% est une solution concentrée employée dans la fabrication de savons‚ de détergents et de produits chimiques.
- L’hydroxyde de sodium (NaOH) à 30% est une solution concentrée utilisée dans la production de papier‚ de textiles et de produits chimiques.
- Le peroxyde d’hydrogène (H2O2) à 35% est une solution concentrée employée comme agent oxydant dans l’industrie chimique et pharmaceutique.
Ces exemples montrent l’importance des solutions concentrées dans divers processus industriels et chimiques.
Différence avec les autres types de solutions
Les solutions concentrées se distinguent des solutions diluées et des solutions stock par leur teneur élevée en soluté et leur rôle spécifique dans les réactions chimiques.
Définition de la solution diluée
Une solution diluée est un type de solution qui contient une faible quantité de soluté dissous dans un grand volume de solvant.
Cette définition implique que la concentration de la solution diluée est faible‚ c’est-à-dire que le rapport entre la quantité de soluté et le volume de solvant est petit.
Les solutions diluées sont souvent obtenues en ajoutant du solvant à une solution concentrée ou stock‚ ce qui permet de réduire la concentration de la solution.
Les solutions diluées sont couramment utilisées en chimie pour préparer des réactifs‚ des échantillons ou des produits finis‚ car elles offrent une plus grande facilité d’utilisation et une meilleure précision dans les mesures.
En résumé‚ la solution diluée est une solution qui contient une faible quantité de soluté dissous dans un grand volume de solvant‚ et est souvent utilisée pour préparer des réactifs ou des échantillons.
Définition de la solution stock
Une solution stock est une solution concentrée qui est préparée à l’avance et stockée pour être utilisée ultérieurement.
Cette solution est généralement préparée en grande quantité et est conservée dans des récipients appropriés pour éviter tout risque de contamination ou de dégradation.
Les solutions stocks sont très pratiques car elles permettent de disposer rapidement d’une solution concentrée pour réaliser des expériences ou des analyses.
Elles sont notamment utilisées en chimie analytique‚ en biochimie et en pharmacologie pour préparer des réactifs‚ des échantillons ou des produits finis.
Les solutions stocks sont également appelées “solutions mères” car elles servent de base pour préparer des solutions plus diluées.
En résumé‚ la solution stock est une solution concentrée préparée à l’avance et stockée pour être utilisée ultérieurement‚ notamment en chimie analytique‚ biochimie et pharmacologie.
Importance en chimie
Les solutions concentrées jouent un rôle crucial en chimie‚ permettant la préparation de réactifs‚ la réalisation d’expériences et l’analyse de substances‚ ainsi que la synthèse de produits chimiques et pharmaceutiques.
Rôle des solutions concentrées en chimie
Les solutions concentrées occupent une place centrale en chimie‚ car elles permettent de préparer des réactifs spécifiques pour les expériences et les analyses. Elles sont utilisées pour stocker et conserver les réactifs chimiques‚ ce qui facilite leur manipulation et leur utilisation.
En outre‚ les solutions concentrées servent de base pour la préparation de solutions plus diluées‚ nécessaires pour certaines expériences ou analyses. Elles permettent également de réaliser des synthèses chimiques complexes‚ telles que la production de médicaments ou de produits chimiques spécifiques.
De plus‚ les solutions concentrées sont essentielles dans les domaines de la chromatographie et de la spectroscopie‚ où elles permettent d’identifier et de caractériser les composés chimiques. En résumé‚ les solutions concentrées sont un outil indispensable en chimie‚ permettant de réaliser une grande variété d’expériences et d’analyses.
Types de solutions chimiques
Les solutions chimiques peuvent être classées en plusieurs types‚ chacun ayant des propriétés et des applications spécifiques. Les solutions acquées‚ par exemple‚ sont des solutions qui contiennent un soluté soluble dans l’eau‚ tandis que les solutions organiques sont des solutions qui contiennent un soluté soluble dans un solvant organique.
Les solutions tampons sont des solutions qui maintiennent un pH constant‚ tandis que les solutions colloïdales sont des solutions qui contiennent des particules colloïdales en suspension. Les solutions électrolytiques‚ quant à elles‚ sont des solutions qui conduisent l’électricité‚ comme les solutions de sels ou d’acides forts.
D’autres types de solutions chimiques incluent les solutions complexes‚ les solutions oxydoréductrices et les solutions de précipitation. Chaque type de solution chimique a ses propres applications et utilisations spécifiques en chimie‚ en biochimie et dans d’autres domaines scientifiques.
En résumé‚ les solutions concentrées sont des préparations chimiques essentielles‚ caractérisées par une grande quantité de soluté dissous dans un volume limité de solvant‚ avec des applications variées en chimie et dans d’autres domaines.
Récapitulation des caractéristiques de la solution concentrée
En fin de compte‚ les solutions concentrées présentent certaines caractéristiques clés qui les définissent et les distinguent des autres types de solutions. Tout d’abord‚ elles contiennent une grande quantité de soluté dissous dans un volume limité de solvant‚ ce qui en fait des préparations très concentrées.
Les solutions concentrées ont également une forte molarité‚ exprimée en moles par litre (mol/L)‚ et sont souvent utilisées comme étalons pour préparer d’autres solutions de concentrations différentes.
De plus‚ ces solutions sont généralement stockées dans des récipients appropriés pour éviter tout risque de contamination ou de dégradation du soluté. En résumé‚ les solutions concentrées sont des préparations chimiques précises et fiables‚ essentielles dans de nombreux domaines scientifiques et industriels.
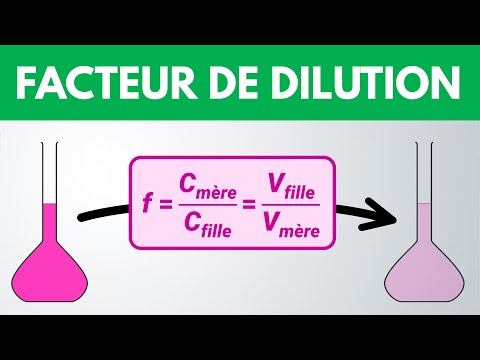
J\
Merci pour cette belle clarification sur les différences entre les solutions concentrées et diluées.
La formule M = n/V m\
L\
Excellent introduction à ce sujet passionnant !
Je recommande cet article à tous ceux qui cherchent à approfondir leurs connaissances sur les solutions chimiques.
Je suis impressionné par l\
Je suis satisfait du ton professionnel et didactique adopté tout au long du texte.