Introduction
Le principe du Châtelier est un concept fondamental en chimie‚ qui décrit comment un système en équilibre chimique répond à des changements dans les conditions de réaction‚ tels que la pression‚ la température ou la concentration.
Définition du principe du Châtelier
Le principe du Châtelier‚ nommé en l’honneur du chimiste français Henri Louis Le Chatelier‚ énonce que lorsqu’un système en équilibre chimique subit une perturbation‚ il répond en modifiant sa composition pour retrouver un nouvel équilibre.
Ce principe permet de comprendre comment les systèmes chimiques réagissent à des changements dans les conditions de réaction‚ tels que la pression‚ la température ou la concentration.
En d’autres termes‚ le principe du Châtelier décrit la tendance d’un système à résister aux changements et à maintenir son équilibre‚ ce qui implique une adaptation des réactions chimiques pour compenser les perturbations.
Cette propriété fondamentale des systèmes chimiques est essentielle pour comprendre et prévoir le comportement des réactions chimiques‚ notamment en ce qui concerne l’influence des facteurs tels que la pression‚ la température et la concentration.
I. Concept du principe du Châtelier
Le principe du Châtelier est basé sur la notion d’équilibre chimique dynamique‚ où les réactions directes et inverses se produisent simultanément‚ mais à des vitesses différentes‚ pour aboutir à un état d’équilibre.
A. Équilibre chimique et thermodynamique
L’équilibre chimique est un état dans lequel les concentrations des réactifs et des produits sont constantes‚ mais non nulles. Cet état est caractérisé par une égalité entre les vitesses de réaction directe et inverse. La thermodynamique joue un rôle essentiel dans l’étude de l’équilibre chimique‚ car elle permet de déterminer la direction spontanée d’une réaction et de calculer les constantes d’équilibre.
En effet‚ la variation d’enthalpie libre (∆G) est un indicateur de la spontanéité d’une réaction. Si ∆G est négatif‚ la réaction est spontanée et ira dans le sens direct. Si ∆G est positif‚ la réaction est non spontanée et ira dans le sens inverse. L’équilibre chimique est atteint lorsque ∆G est égal à zéro.
B. La réaction en équilibre et la constante d’équilibre
Une réaction en équilibre est caractérisée par une égalité entre les vitesses de réaction directe et inverse. Les concentrations des réactifs et des produits sont constantes‚ mais non nulles. La constante d’équilibre (K) est une mesure de l’état d’équilibre d’une réaction.
La constante d’équilibre est définie comme le rapport des concentrations des produits à celles des réactifs‚ élevées à leurs coefficients stœchiométriques respectifs. Elle est une grandeur thermodynamique qui ne dépend que de la température et est indépendante des concentrations initiales des réactifs.
La valeur de K permet de déterminer la direction de la réaction et de prédire l’état d’équilibre. Si K est élevé‚ la réaction est fortement déplacée vers les produits‚ tandis que si K est faible‚ la réaction est fortement déplacée vers les réactifs.
II. Applications du principe du Châtelier
Le principe du Châtelier a de nombreuses applications pratiques‚ notamment dans la modification des conditions de réaction pour influencer l’équilibre chimique et améliorer les rendements des réactions.
A. Influence de la pression sur l’équilibre
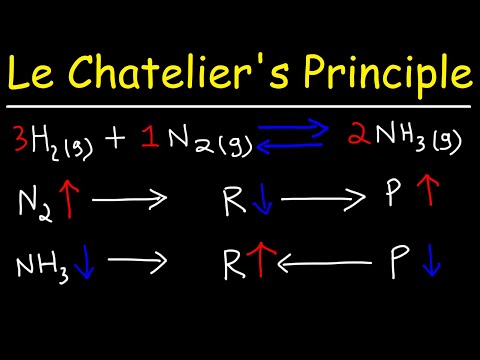
L’influence de la pression sur l’équilibre chimique est une application directe du principe du Châtelier. Lorsqu’une réaction équilibrée est soumise à une augmentation de pression‚ le système tend à réduire le volume du système pour résister à cette augmentation. Cela signifie que les réactions qui impliquent une diminution de volume sont favorisées‚ tandis que celles qui impliquent une augmentation de volume sont défavorisées.
Cette influence de la pression sur l’équilibre est particulièrement importante dans les réactions gazeuses‚ où la modification de la pression peut entraîner des changements significatifs dans l’équilibre chimique. Par exemple‚ dans la réaction entre l’azote et l’hydrogène pour former de l’ammoniac‚ une augmentation de pression favorise la formation de l’ammoniac.
B. Influence de la température sur l’équilibre
L’influence de la température sur l’équilibre chimique est une autre application du principe du Châtelier. Lorsqu’une réaction équilibrée est soumise à une variation de température‚ le système tend à s’adapter pour résister à ce changement. Les réactions endothermiques‚ qui absorbent de l’énergie thermique‚ sont favorisées à haute température‚ tandis que les réactions exothermiques‚ qui libèrent de l’énergie thermique‚ sont favorisées à basse température.
Cette influence de la température sur l’équilibre est particulièrement importante dans les réactions chimiques où la chaleur est impliquée. Par exemple‚ dans la réaction entre le calcium carbonate et l’acide chlorhydrique pour former du dioxyde de carbone et du chlorure de calcium‚ une augmentation de température favorise la formation du dioxyde de carbone.
C. Influence de la concentration sur l’équilibre
L’influence de la concentration sur l’équilibre chimique est une autre application du principe du Châtelier. Lorsqu’il y a une variation de concentration d’un des réactifs ou des produits‚ le système tend à s’adapter pour résister à ce changement. Si la concentration d’un réactif est augmentée‚ le système répond en favorisant la réaction qui consomme ce réactif‚ et inversement si la concentration d’un produit est augmentée‚ le système répond en favorisant la réaction qui forme ce produit.
Cette influence de la concentration sur l’équilibre est particulièrement importante dans les réactions chimiques où les concentrations des réactifs et des produits varient. Par exemple‚ dans la réaction entre l’hydrogène et l’iode pour former de l’hydroiode‚ une augmentation de la concentration de l’hydrogène favorise la formation de l’hydroiode.
III. Exemples d’applications du principe du Châtelier
Ce chapitre présente quelques exemples concrets d’applications du principe du Châtelier‚ illustrant son importance dans la compréhension et la maîtrise des réactions chimiques.
A. Réactions réversibles et catalyseurs
Les réactions réversibles sont des processus chimiques qui peuvent se produire dans les deux sens‚ c’est-à-dire que les produits peuvent se transformer en réactifs et inversement. Le principe du Châtelier s’applique parfaitement à ces réactions‚ car il permet de prévoir l’effet d’un changement des conditions de réaction sur l’équilibre.
Les catalyseurs jouent un rôle important dans les réactions réversibles‚ car ils permettent d’accélérer la vitesse de réaction sans être consommés au cours de la réaction. Le principe du Châtelier montre que l’ajout d’un catalyseur ne modifie pas l’équilibre chimique‚ mais permet d’atteindre cet équilibre plus rapidement.
Ces concepts sont essentiels pour comprendre les mécanismes chimiques complexes et pour optimiser les conditions de réaction pour obtenir les résultats souhaités.
B. La loi d’action de masse et la cinétique chimique
La loi d’action de masse‚ également connue sous le nom de loi de Guldberg et Waage‚ décrit la relation entre la concentration des réactifs et la vitesse de réaction. Cette loi est étroitement liée au principe du Châtelier‚ car elle permet de comprendre comment les changements de concentration influent sur l’équilibre chimique.
La cinétique chimique étudie les vitesses de réaction et les mécanismes chimiques qui les régissent. Le principe du Châtelier est essentiel pour comprendre comment les changements des conditions de réaction affectent les vitesses de réaction et l’équilibre chimique.
L’application conjointe de la loi d’action de masse et du principe du Châtelier permet de prévoir et de contrôler les réactions chimiques‚ ce qui est essentiel pour de nombreuses applications industrielles et scientifiques.
IV. Conclusion
En résumé‚ le principe du Châtelier est un outil puissant pour comprendre et prévoir les équilibres chimiques‚ avec des applications variées dans les domaines de la chimie‚ de la physico-chimie et de la biologie;
Importance du principe du Châtelier en chimie
Le principe du Châtelier occupe une place centrale en chimie‚ car il permet de comprendre et de prévoir les équilibres chimiques‚ ainsi que les effets des changements de conditions sur ces équilibres. Cette compréhension est essentielle pour la conception et l’optimisation de réactions chimiques‚ notamment dans l’industrie chimique et pharmaceutique.
De plus‚ le principe du Châtelier est également crucial en chimie physique‚ où il permet d’étudier les propriétés thermodynamiques des systèmes chimiques. Enfin‚ il est également utilisé en biologie‚ pour comprendre les processus biochimiques et les mécanismes de régulation des réactions métaboliques.
En somme‚ le principe du Châtelier est un outil fondamental pour les chimistes‚ qui leur permet de comprendre et de maîtriser les phénomènes chimiques‚ et ainsi de développer de nouvelles technologies et de nouveaux produits.
Je vous conseille de ajouter quelques exemples concrets pour illustrer les concepts théoriques présentés dans l
Je vous félicite pour votre travail de recherche approfondi sur le rôle de la thermodynamique dans l
Excellente introduction au principe du Châtelier ! Vous avez réussi à présenter clairement le concept fondamental en chimie qui décrit comment un système en équilibre chimique répond à des changements dans les conditions de réaction.
Je suis impressionnée par la clarté de votre définition du principe du Châtelier ! Vous avez réussi à expliquer complexité de manière simple et concise.
Je pense que vous auriez pu approfondir certaines parties de l
J