Introduction
Dans le domaine de l’électrochimie, les concepts d’anode et de cathode sont essentiels pour comprendre les phénomènes électriques et chimiques qui se produisent.
Importance de la compréhension des électrodes
La compréhension des électrodes est cruciale pour maîtriser les principes fondamentaux de l’électrochimie et de l’électricité. Les électrodes sont des composants clés dans de nombreux systèmes, tels que les batteries, les piles à combustible et les électrolyseurs.
Une bonne connaissance des électrodes permet de concevoir et d’optimiser ces systèmes pour améliorer leur efficacité et leur durée de vie. De plus, la compréhension des électrodes est essentielle pour comprendre les phénomènes électrochimiques qui se produisent à leur surface, tels que l’oxydation et la réduction.
Ainsi, il est impératif de bien comprendre les notions d’anode et de cathode pour maîtriser les principes de base de l’électrochimie et de l’électricité.
Qu’est-ce que l’anode ?
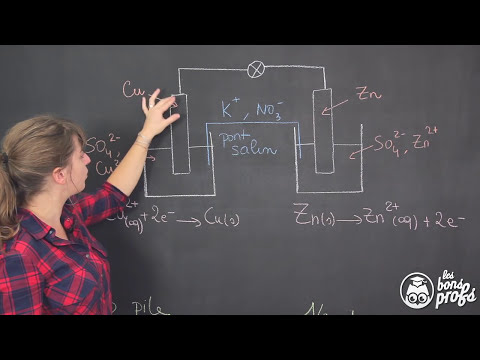
L’anode est l’électrode où se produit l’oxydation, c’est-à-dire où les électrons sont libérés, lors d’une réaction électrochimique.
Anode definition
La définition de l’anode est étroitement liée à son rôle dans les réactions électrochimiques. L’anode est définie comme l’électrode positive où se produit l’oxydation, c’est-à-dire où les électrons sont libérés. Cette définition implique que l’anode est le site où les espèces chimiques perdent des électrons, ce qui entraîne une augmentation de leur charge positive. Dans ce contexte, l’anode est également appelée électrode d’oxydation. La compréhension de la définition de l’anode est essentielle pour saisir les principes fondamentaux de l’électrochimie et de ses applications pratiques.
Rôle de l’anode dans les réactions électrochimiques
Dans les réactions électrochimiques, l’anode joue un rôle clé en tant que site d’oxydation. C’est à l’anode que les espèces chimiques perdent des électrons, ce qui entraîne une augmentation de leur charge positive. Cela permet la formation d’ions positifs qui peuvent alors migrer vers la cathode. L’anode est également responsable de la libération d’électrons, qui peuvent alors contribuer au flux de courant électrique. En résumé, le rôle de l’anode est essentiel pour initier et maintenir les réactions électrochimiques, et sa compréhension est cruciale pour maîtriser les phénomènes électrochimiques.
Qu’est-ce que la cathode ?
La cathode est l’électrode où se produit la réduction, c’est-à-dire où les espèces chimiques gagnent des électrons et perdent leur charge positive.
Cathode meaning
Le terme « cathode » provient du grec « kathodos », signifiant « chemin descendant ». Cette définition fait référence au flux d’électrons qui descendent vers l’électrode négative lors d’une réaction électrochimique. La cathode est donc l’électrode où les électrons affluent, entraînant une réduction des espèces chimiques impliquées. Cette notion est essentielle pour comprendre les mécanismes fondamentaux de l’électrochimie et de la physique des semi-conducteurs. En résumé, la cathode est l’électrode où se produit la réduction, c’est-à-dire où les espèces chimiques gagnent des électrons et perdent leur charge positive.
Rôle de la cathode dans les réactions électrochimiques
Dans les réactions électrochimiques, la cathode joue un rôle crucial en tant que site de réduction. C’est à cette électrode que les ions positifs (cations) ou les molécules oxydées viennent se réduire en gagnant des électrons. Cette réduction entraîne une perte de charge positive et une variation de l’état d’oxydation des espèces chimiques impliquées. La cathode est ainsi le lieu où se produit la récupération d’énergie chimique, ce qui en fait un élément clé dans les systèmes électrochimiques tels que les batteries, les piles à combustible et les cellules électrolytiques.
Bases de l’électrochimie
L’électrochimie étudie les réactions chimiques qui impliquent un transfert d’électrons entre des espèces chimiques et des électrodes, générant un courant électrique.
Electrochemistry basics
L’électrochimie est une branche de la chimie qui étudie les réactions chimiques qui impliquent un transfert d’électrons. Ces réactions ont lieu à l’interface entre une phase conductrice, comme un métal, et une phase ionique, comme une solution électrolytique. Les électrodes jouent un rôle crucial dans ces réactions, car elles permettent le transfert d’électrons entre les espèces chimiques et le circuit électrique. L’électrochimie est à la base de nombreuses applications, notamment la production d’énergie électrique, la corrosion des matériaux et la synthèse de composés chimiques.
Oxidation reaction et réduction reaction
Dans le contexte de l’électrochimie, les réactions d’oxydation et de réduction sont deux processus fondamentaux qui ont lieu respectivement à l’anode et à la cathode. La réaction d’oxydation correspond à la perte d’électrons par une espèce chimique, tandis que la réaction de réduction correspond à la gain d’électrons. Ces réactions sont liées, car la perte d’électrons à l’anode est compensée par le gain d’électrons à la cathode. L’équilibre entre ces deux réactions permet de maintenir le flux de courant électrique.
Les composants de la batterie
Une batterie est composée de plusieurs éléments clés, notamment l’anode, la cathode, l’électrolyte et le séparateur, qui travaillent ensemble pour générer du courant électrique.
Battery components
Les composants de base d’une batterie comprennent l’anode, la cathode, l’électrolyte et le séparateur. L’anode est le pôle négatif où se produit l’oxydation, tandis que la cathode est le pôle positif où se produit la réduction.
Ces deux électrodes sont séparées par un électrolyte, qui est une substance conductrice ionique permettant le transfert de charges entre les deux électrodes. Le séparateur, quant à lui, empêche les deux électrodes de se toucher et de provoquer une décharge accidentelle.
Ces composants travaillent ensemble pour générer du courant électrique lorsque la batterie est connectée à un circuit électrique.
Flux de courant électrique
Le flux de courant électrique est le mouvement des électrons qui circulent entre l’anode et la cathode d’une batterie. Lorsqu’une batterie est connectée à un circuit électrique, les électrons s’échappent de l’anode et se déplacent vers la cathode.
Ce mouvement d’électrons crée un champ électrique qui permet le transfert d’énergie électrique. Le sens du courant électrique est conventionnellement défini comme allant de la cathode vers l’anode.
Le flux de courant électrique est mesuré en ampères (A) et est un paramètre essentiel pour caractériser les performances d’une batterie ou d’un système électrique.
Le processus d’électrolyse
L’électrolyse est un processus chimique où une substance est décomposée en deux substances différentes à l’aide d’un courant électrique.
Electrolysis process
L’électrolyse est un processus chimique complexe qui implique la décomposition d’une substance chimique en deux substances différentes à l’aide d’un courant électrique. Ce processus a lieu dans un dispositif appelé cellule électrolytique, qui comprend deux electrodes, l’anode et la cathode, plongées dans un électrolyte. Lorsqu’un courant électrique est appliqué, les ions se déplacent vers les electrodes, entraînant des réactions d’oxydation et de réduction. Les produits de réaction sont alors collectés respectivement à l’anode et à la cathode. L’électrolyse est utilisée dans de nombreuses applications industrielles, notamment la production d’aluminium, la fabrication de piles et la purification de l’eau.