I. Introduction
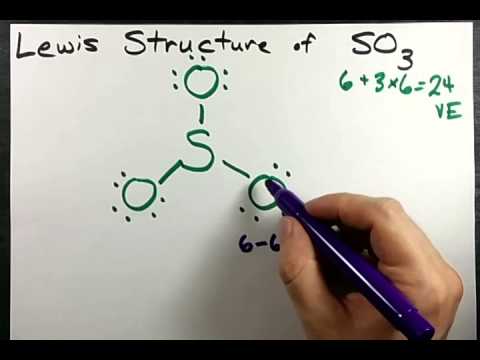
Le trioxyde de soufre, également connu sous le nom de trioxyde de sulfure, est un composé chimique inorganique de formule SO3, présentant une structure moléculaire pyramidale.
A. Définition et structure du trioxyde de soufre
Le trioxyde de soufre est un composé chimique inorganique de formule SO3, appartenant à la famille des oxydes de soufre. Sa structure moléculaire est pyramidale, avec un atome de soufre central lié à trois atomes d’oxygène. Cette géométrie pyramidale confère au trioxyde de soufre des propriétés particulières, notamment une forte polarité et une grande réactivité. Le trioxyde de soufre est un solide blanc cristallin à température ambiante, mais il peut également exister sous forme de liquide ou de gaz en fonction des conditions de température et de pression.
II. Propriétés physiques et chimiques
Les propriétés physiques et chimiques du trioxyde de soufre sont caractérisées par une grande réactivité, une forte polarité et des propriétés acides.
A. Propriétés physiques
Les propriétés physiques du trioxyde de soufre sont caractérisées par une masse molaire de 80,06 g/mol, une densité de 1,97 g/cm³ et une température de fusion de 16,8°C.
Le trioxyde de soufre est un solide blanc cristallin à température ambiante, mais il peut être obtenu sous forme de liquide incolore et volatile à température élevée.
Ce composé est très soluble dans l’eau, ce qui conduit à la formation d’acide sulfurique.
Les propriétés physiques du trioxyde de soufre en font un composé chimique très réactif et difficile à stocker.
B. Propriétés chimiques
Les propriétés chimiques du trioxyde de soufre sont dominées par sa forte réactivité, due à la présence d’un atome de soufre très électronégatif.
Le trioxyde de soufre est un oxydant puissant, capable de réagir avec de nombreux éléments et composés, notamment les métaux et les composés organiques.
Il forme facilement des liaison covalentes avec d’autres atomes, conduisant à la formation d’anhydride sulfurique et d’oxyde de soufre.
Ces propriétés chimiques en font un composé chimique essentiel pour la production d’acide sulfurique et d’autres produits chimiques dérivés.
III. Synthèse du trioxyde de soufre
La synthèse du trioxyde de soufre est réalisée par combustion du soufre ou de l’anhydride sulfurique en présence d’oxygène à haute température.
A. Méthodes de synthèse
Les méthodes de synthèse du trioxyde de soufre sont variées et dépendent des conditions opératoires et des produits de départ. La combustion du soufre élémentaire en présence d’oxygène à haute température (entre 400°C et 600°C) est une méthode couramment utilisée. L’oxydation de l’anhydride sulfurique (SO2) en présence d’un catalyseur tel que le platine ou le vanadium peut également être employée. Dans certaines conditions, la réaction entre le dioxyde de soufre et l’oxygène peut également produire du trioxyde de soufre.
IV. Réactions chimiques
Le trioxyde de soufre est un puissant agent oxydant qui réagit vigoureusement avec de nombreux éléments et composés, notamment les métaux et les composés organiques.
A. Réactions avec les métaux
Les réactions du trioxyde de soufre avec les métaux sont généralement violentes et exothermiques. Par exemple, la réaction avec le sodium produit de l’anhydride sulfurique et du dioxyde de soufre ⁚
Ces réactions peuvent être dangereuses en raison de la formation de produits gazeux toxiques et corrosifs.
Les métaux de transition, tels que le cuivre et le zinc, réagissent également avec le trioxyde de soufre pour former des sels de sulfate.
B. Réactions avec les composés organiques
Le trioxyde de soufre réagit avec les composés organiques pour former des produits de sulfonation ou de sulfoxydation. Ces réactions sont souvent catalysées par des acides ou des bases.
Par exemple, la réaction avec le benzène produit de l’acide benzensulfonique ⁚
- C6H6 + SO3 → C6H5SO3H
Ces réactions sont importantes dans l’industrie chimique pour la production de dérivés sulfonés utilisés dans les détergents, les plastifiants et les médicaments.
V. Applications industrielles
Le trioxyde de soufre est principalement utilisé pour la production d’acide sulfurique, d’anhydride sulfurique et d’oxyde de soufre.
A. Production d’acide sulfurique
La production d’acide sulfurique est l’une des applications les plus importantes du trioxyde de soufre. Dans ce processus, le trioxyde de soufre est dissous dans de l’eau pour former de l’acide sulfurique concentré. Cette réaction est exothermique, libérant de la chaleur et nécessitant donc un système de refroidissement efficace. L’acide sulfurique produit est ensuite dilué pour obtenir la concentration souhaitée. Cette substance est essentielle dans de nombreuses industries, notamment la production de fertilisants, de produits chimiques et de matériaux de construction.
B. Autres applications
En plus de la production d’acide sulfurique, le trioxyde de soufre est utilisé dans diverses applications industrielles. Il est employé comme agent de séchage dans la production de pesticides, de médicaments et de matières plastiques. Le trioxyde de soufre est également utilisé comme catalyseur dans certaines réactions chimiques, telles que la production de dioxyde de titane. De plus, il est utilisé comme agent de déshydratation dans la production de certains matériaux, tels que les résines époxy. Enfin, le trioxyde de soufre est employé dans la purification de gaz naturel et de pétrole.
VI. Dangers et effets sur la santé
Le trioxyde de soufre est considéré comme un produit chimique dangereux, pouvant causer des problèmes de santé graves et des dommages environnementaux significatifs.
A. Pollution atmosphérique
La libération de trioxyde de soufre dans l’atmosphère contribue à la formation d’aérosols acidifiants, qui peuvent se combiner avec l’eau et les oxydes d’azote pour former des pluies acides.
Ces précipitations acidifiées peuvent avoir des effets néfastes sur les écosystèmes, en altérant la chimie des sols et des eaux, ainsi que sur les infrastructures et les monuments historiques.
De plus, le trioxyde de soufre participe à la formation de smog et de particules fines, qui peuvent avoir des impacts sanitaires négatifs sur la population exposée.
B. Effets sur la santé
L’inhalation de trioxyde de soufre peut causer des problèmes respiratoires graves, tels que l’asthme, la bronchite et la pneumonie;
Les effets sur la santé sont principalement liés à l’irritation des muqueuses et des voies respiratoires, entraînant des symptômes tels que la toux, l’infusion oculaire et la douleur thoracique.
Des expositions prolongées ou à haute concentration peuvent également entraîner des effets systémiques, tels que des problèmes cardiovasculaires et des lésions pulmonaires permanentes.