Introduction
La loi de conservation de la matière est un principe fondamental en chimie qui établit que la masse totale d’un système reste constante lors d’une réaction chimique.
Définition de la loi de conservation de la matière
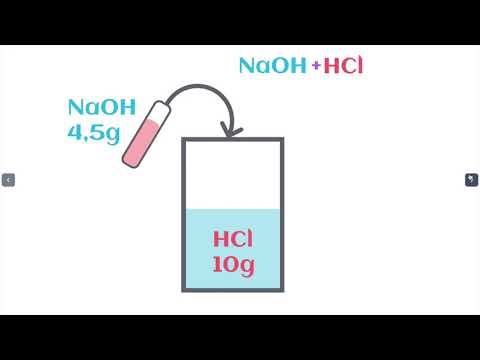
La loi de conservation de la matière est une loi physique fondamentale qui énonce que la masse totale d’un système isolé reste constante au cours d’une réaction chimique. Cette loi signifie que la quantité d’éléments chimiques présents dans un système ne change pas, mais seuls les arrangements des molécules varient.
Cette loi est souvent exprimée par l’équation suivante ⁚ masse initiale = masse finale, où la masse initiale correspond à la somme des masses des réactifs et la masse finale correspond à la somme des masses des produits.
La loi de conservation de la matière est une règle essentielle en chimie qui permet de comprendre et de prévoir les résultats des réactions chimiques, ainsi que de calculer les quantités de substances impliquées.
Principe de base
Le principe de base de la loi de conservation de la matière repose sur l’idée que la masse est une propriété conservée lors d’une réaction chimique.
Le principe de conservation de la masse
Le principe de conservation de la masse établit que la masse totale d’un système fermé reste constante lors d’une réaction chimique. Cette loi fondamentale signifie que la masse des réactifs est égale à la masse des produits. Ainsi, lors d’une réaction chimique, il n’y a ni création ni destruction de matière, mais uniquement une transformation des molécules initiales en nouvelles molécules. Ce principe est vérifié expérimentalement et est considéré comme un des fondements de la chimie.
Ce principe permet de comprendre que la quantité d’éléments chimiques dans un compound est conservée lors d’une réaction chimique, ce qui signifie que la masse totale des éléments chimiques initiaux est égale à la masse totale des éléments chimiques finaux.
Le système fermé et le système ouvert
En chimie, un système peut être considéré comme fermé ou ouvert. Un système fermé est un système dans lequel la matière ne peut pas entrer ou sortir, mais où les réactions chimiques peuvent se produire. Dans un tel système, la masse totale est conservée, car aucune matière ne peut être ajoutée ou retirée.
D’un autre côté, un système ouvert est un système dans lequel la matière peut entrer ou sortir. Cependant, même dans un système ouvert, la loi de conservation de la matière est toujours applicable, car la masse totale des éléments chimiques initiaux est égale à la masse totale des éléments chimiques finaux, compte tenu des entrées et des sorties de matière.
La réaction chimique élémentaire
Une réaction chimique élémentaire est une transformation chimique qui implique une seule étape, où des molecules réactantes sont transformées en produits, conformément au principe de conservation de la masse.
L’exemple de la combustion du méthane
L’exemple de la combustion du méthane (CH4) illustre parfaitement le principe de conservation de la masse. Lors de cette réaction, le méthane réagit avec l’oxygène (O2) pour produire de la vapeur d’eau (H2O) et du dioxyde de carbone (CO2). La masse initiale du méthane et de l’oxygène est égale à la masse finale des produits, démontrant ainsi la conservation de la masse.
Voici l’équation bilan de la réaction ⁚
- CH4 + 2O2 → CO2 + 2H2O
Cette équation montre que la masse des réactifs est égale à la masse des produits, vérifiant ainsi la loi de conservation de la matière.
L’exemple de la synthèse de l’ammoniac
L’exemple de la synthèse de l’ammoniac (NH3) à partir de l’azote (N2) et de l’hydrogène (H2) est un autre exemple illustrant la loi de conservation de la matière. Lors de cette réaction, les molécules d’azote et d’hydrogène se combinent pour former des molécules d’ammoniac.
Voici l’équation bilan de la réaction ⁚
Cette équation démontre que la masse totale des réactifs est égale à la masse totale des produits, conformément au principe de conservation de la masse. Cette réaction est un exemple classique de réaction chimique élémentaire où la masse est conservée.
L’analyse chimique et la loi de conservation de la matière
L’analyse chimique permet de déterminer la quantité d’éléments chimiques présents dans un compound, vérifiant ainsi la loi de conservation de la matière.
La quantité d’éléments chimiques dans un compound
Lors de l’analyse d’un compound, il est essentiel de déterminer la quantité d’éléments chimiques qui le composent. Cette quantité est exprimée en termes de masse ou de nombre d’atomes. La loi de conservation de la matière s’applique également à cette échelle, car la masse totale des éléments chimiques présents dans le compound est égale à la masse du compound lui-même.
Cette notion est fondamentale en chimie, car elle permet de comprendre les réactions chimiques et les transformations qui ont lieu au cours de celles-ci. En effet, lors d’une réaction chimique, les éléments chimiques se recombinent pour former de nouveaux compounds, mais leur masse totale reste inchangée.
La masse totale d’un système fermé
Un système fermé est un système dans lequel il n’y a pas d’échange de matière avec l’extérieur. Dans ce type de système, la masse totale est conservée, ce qui signifie que la somme des masses des éléments chimiques et des compounds présents dans le système est constante.
Cette conservation de la masse totale est une conséquence directe du principe de conservation de la matière. En effet, lors d’une réaction chimique dans un système fermé, les éléments chimiques se recombinent pour former de nouveaux compounds, mais leur masse totale reste inchangée.
Cette notion est fondamentale en chimie, car elle permet de prévoir et de comprendre les résultats des réactions chimiques dans des systèmes fermés.
Exemples concrets
Ces exemples illustrent l’application de la loi de conservation de la matière dans des situations concrètes, telles que la réaction de combustion du carburant et la production de chlorure de sodium.
La réaction de combustion du carburant
Lors de la combustion du carburant, il y a une réaction chimique entre le carburant et l’oxygène de l’air, produisant du dioxyde de carbone et de l’eau.
Par exemple, lors de la combustion du gazole, la réaction chimique est la suivante ⁚
- C12H26 (carburant) + 18O2 → 12CO2 + 13H2O
Dans cette réaction, la masse totale des réactifs est égale à la masse totale des produits, illustrant ainsi la loi de conservation de la matière.
La masse du carburant et de l’oxygène est conservée et transformée en dioxyde de carbone et eau, sans perte ni gain de masse.
La production de chlorure de sodium
La production de chlorure de sodium (sel) est une réaction chimique qui illustre parfaitement la loi de conservation de la matière.
Dans cette réaction, le chlore gazeux réagit avec le sodium métallique pour former du chlorure de sodium ⁚
- 2Na (sodium) + Cl2 (chlore) → 2NaCl (chlorure de sodium)
Dans cette réaction, la masse du sodium et du chlore est conservée et transformée en chlorure de sodium.
La quantité d’éléments chimiques initiaux (sodium et chlore) est égale à la quantité d’éléments chimiques finals (chlorure de sodium).
Cette réaction démontre que la loi de conservation de la matière est respectée, la masse totale du système restant constante.